жҚ®ж–°еҚҺзҪ‘ж¶ҲжҒҜпјҡжҲ‘еӣҪйҰ–йғЁз–«иӢ—з®ЎзҗҶз«Ӣжі•жңүдәҶж–°иҝӣеұ•пјҢз»ҸеӣҪеҠЎйҷўеёёеҠЎдјҡи®®и®Ёи®әйҖҡиҝҮзҡ„гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲиҚүжЎҲпјүгҖӢпјҲд»ҘдёӢз®Җз§°гҖҠиҚүжЎҲгҖӢпјүиҝ‘ж—Ҙиө·ејҖеҫҒе…¬дј—ж„Ҹи§ҒгҖӮ
дёҺеҺ»е№ҙ11жңҲе…¬еёғзҡ„гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢпјҲд»ҘдёӢз®Җз§°гҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢпјүзӣёжҜ”пјҢиҚүжЎҲжқЎж¬ҫд»Һ100жқЎ“зҳҰиә«”иҮі88жқЎпјҢ并еҠ еӨ§еҜ№з”ҹдә§гҖҒй”Җе”®еҒҮеҠЈз–«иӢ—зӯүиҝқжі•иЎҢдёәзҡ„еӨ„зҪҡеҠӣеәҰпјҢж–°еўһдјҒдёҡеҶ…йғЁдёҫжҠҘдәәеҘ–еҠұгҖӮжҚ®жӮүпјҢгҖҠиҚүжЎҲгҖӢе…¬ејҖеҫҒжұӮж„Ҹи§ҒиҮі2019е№ҙ2жңҲ3ж—Ҙз»“жқҹгҖӮ
иҝӣеұ•
е…¬ејҖеҫҒжұӮ3еӨ© 收еҲ°зҷҫдҪҷжқЎж„Ҹи§Ғ
дҪңдёәе…Ёзҗғд№ҹжҳҜжҲ‘еӣҪйҰ–йғЁз–«иӢ—жі•пјҢгҖҠз–«иӢ—з®ЎзҗҶжі•гҖӢз«Ӣжі•иҝӣзЁӢйўҮеҸ—е…іжіЁгҖӮи®°иҖ…еңЁдёӯеӣҪдәәеӨ§зҪ‘зңӢеҲ°пјҢгҖҠиҚүжЎҲгҖӢе·Із»ҸеӣҪеҠЎйҷўеёёеҠЎдјҡи®®и®Ёи®әйҖҡиҝҮпјҢ并иҮӘ2019е№ҙ1жңҲ4ж—Ҙиө·иҮі2жңҲ3ж—ҘеҫҒжұӮе…¬дј—ж„Ҹи§ҒгҖӮжҲӘиҮі1жңҲ7ж—Ҙ17ж—¶пјҢ已收еҲ°133жқЎж„Ҹи§ҒгҖӮ
гҖҠиҚүжЎҲгҖӢе…ұ11з« 88жқЎпјҢеҲҶеҲ«дёәжҖ»еҲҷгҖҒз–«иӢ—з ”еҲ¶е’ҢдёҠеёӮи®ёеҸҜгҖҒз–«иӢ—з”ҹдә§е’Ңжү№зӯҫеҸ‘гҖҒдёҠеёӮеҗҺз ”з©¶е’Ңз®ЎзҗҶгҖҒз–«иӢ—жөҒйҖҡгҖҒйў„йҳІжҺҘз§ҚгҖҒйў„йҳІжҺҘз§ҚејӮеёёеҸҚеә”зӣ‘жөӢдёҺиЎҘеҒҝгҖҒдҝқйҡңжҺӘж–ҪгҖҒзӣ‘зқЈз®ЎзҗҶгҖҒжі•еҫӢиҙЈд»»гҖҒйҷ„еҲҷгҖӮ
иҚүжЎҲж•°жҳ“е…¶зЁҝиҖҢжҲҗгҖӮ2018е№ҙ11жңҲ11ж—ҘпјҢз”ұеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖгҖҒеӣҪ家еҚ«з”ҹеҒҘеә·е§”е‘ҳдјҡиө·иҚүзҡ„гҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢпјҢејҖе§ӢиҝӣиЎҢдёәжңҹеҚҠдёӘжңҲзҡ„еҫҒжұӮж„Ҹи§Ғйҳ¶ж®өгҖӮ
жҚ®дёӯеӣҪдәәеӨ§зҪ‘ж¶ҲжҒҜпјҢеҫҒжұӮж„Ҹи§Ғз»“жқҹеҗҺпјҢеӣҪ家еёӮеңәзӣ‘з®ЎжҖ»еұҖдјҡеҗҢжңүе…ійғЁй—Ёиө·иҚүгҖҠз–«иӢ—з®ЎзҗҶжі•пјҲиҚүжЎҲйҖҒе®ЎзЁҝпјүгҖӢпјҢдәҺ2018е№ҙ11жңҲжҠҘйҖҒеӣҪеҠЎйҷўгҖӮ
收еҲ°йҖҒе®ЎзЁҝеҗҺпјҢеҸёжі•йғЁеҫҒжұӮжңүе…ійғЁй—ЁгҖҒзңҒзә§дәәж°‘ж”ҝеәңгҖҒйғЁеҲҶеҚҸдјҡе’ҢдјҒдёҡзҡ„ж„Ҹи§ҒпјҢиөҙз–«иӢ—з”ҹдә§дјҒдёҡиҝӣиЎҢи°ғз ”пјҢеҸ¬ејҖеә§и°Ҳдјҡеҗ¬еҸ–з–«иӢ—з”ҹдә§дјҒдёҡгҖҒз–ҫз—…йў„йҳІжҺ§еҲ¶жңәжһ„гҖҒжҺҘз§ҚеҚ•дҪҚгҖҒең°ж–№зӣ‘з®ЎйғЁй—Ёе’Ң专家зҡ„ж„Ҹи§ҒпјҢеңЁжӯӨеҹәзЎҖдёҠпјҢ
дјҡеҗҢеёӮеңәзӣ‘з®ЎжҖ»еұҖгҖҒиҚҜзӣ‘еұҖгҖҒеҚ«з”ҹеҒҘеә·е§”зӯүйғЁй—ЁеҜ№йҖҒе®ЎзЁҝдҪңдәҶз ”з©¶гҖҒеҚҸи°ғгҖҒдҝ®ж”№пјҢеҪўжҲҗдәҶгҖҠиҚүжЎҲгҖӢгҖӮ
дәүи®®
з–«иӢ—дёҚиүҜеҸҚеә”иЎҘеҒҝж ҮеҮҶеҫ…жҳҺзЎ®
гҖҠз–«иӢ—з®ЎзҗҶжі•гҖӢз«Ӣжі•еҸӮдёҺиҖ…гҖҒжё…еҚҺеӨ§еӯҰжі•еӯҰйҷўеҠ©зҗҶз ”з©¶е‘ҳеј жҖЎи®ӨдёәпјҢжӯӨж¬ЎгҖҠиҚүжЎҲгҖӢдҪ“зҺ°дәҶжңҖдёҘи°Ёзҡ„ж ҮеҮҶгҖҒжңҖдёҘж јзҡ„зӣ‘з®ЎгҖҒжңҖдёҘеҺүзҡ„еӨ„зҪҡгҖҒжңҖдёҘиӮғзҡ„й—®иҙЈ“еӣӣдёӘжңҖдёҘ”зҡ„иҰҒжұӮпјҢ并еңЁеҗёж”¶зӨҫдјҡеҗ„з•Ңзҡ„ж„Ҹи§ҒеҗҺпјҢиҝӣиЎҢдәҶиҝӣдёҖжӯҘзҡ„з»ҶеҢ–е’ҢдјҳеҢ–гҖӮжҜ”еҰӮпјҢгҖҠиҚүжЎҲгҖӢеңЁжҖ»еҲҷдёӯжҳҺ确规е®ҡдәҶеӣҪ家еҜ№з–«иӢ—е®һиЎҢжңҖдёҘж јзҡ„з®ЎзҗҶеҲ¶еәҰгҖӮ
дҪҶдёҚе°‘жқЎж¬ҫд»Қеӯҳжңүдәүи®®гҖӮдҫӢеҰӮпјҢдәүи®әжҝҖзғҲзҡ„йў„йҳІжҺҘз§ҚејӮеёёеҸҚеә”иЎҘеҒҝжңәеҲ¶гҖӮз®ҖиҖҢиЁҖд№ӢпјҢеҚіеҜ№з–«иӢ—дёҚиүҜеҸҚеә”еҸ—е®іиҖ…иҜҘеҰӮдҪ•иЎҘеҒҝгҖӮ
з”ұдәҺдёӘдҪ“е·®ејӮпјҢеҸ—з§ҚиҖ…жҢү照规иҢғжҺҘз§ҚзЁӢеәҸжҺҘз§ҚеҗҲж јз–«иӢ—еҗҺпјҢд»ҚеҸҜиғҪдә§з”ҹдёҘйҮҚдёҚиүҜеҸҚеә”иҮҙж®ӢгҖҒиҮҙжӯ»пјҢдҪҶжҜ”иҫғзҪ•и§ҒпјҢдёҡз•Ңе°Ҷе…¶е®ҡд№үдёә“жҒ¶йӯ”жҠҪзӯҫ”гҖӮзҺ°е®һдёӯпјҢз”ұдәҺиЎҘеҒҝж ҮеҮҶдёҚдёҖгҖҒиЎҘеҒҝзЁӢеәҸз№Ғзҗҗзӯүй—®йўҳпјҢиў«“жҒ¶йӯ””жҠҪдёӯзҡ„еҸ—е®іиҖ…зҡ„зҗҶиө”д№Ӣи·Ҝеӣ°йҡҫйҮҚйҮҚгҖӮ
еҮ з»Ҹи®Ёи®әпјҢгҖҠиҚүжЎҲгҖӢд»Қз»ҙжҢҒдәҶдёҺгҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢзӣёеҗҢзҡ„规е®ҡгҖӮ
еңЁжҲ‘еӣҪпјҢе…Қ疫规еҲ’з–«иӢ—пјҲеҚідёҖзұ»з–«иӢ—пјүе…Қиҙ№гҖҒејәеҲ¶жҺҘз§ҚпјҢеҰӮе„ҝз«ҘжҺҘз§Қзҡ„и„ҠзҒ°гҖҒйә»з–№зӯүз–«иӢ—гҖӮйқһе…Қ疫规еҲ’з–«иӢ—пјҲеҚідәҢзұ»з–«иӢ—пјүиҮӘиҙ№гҖҒиҮӘж„ҝжҺҘз§ҚпјҢеҰӮзӢӮзҠ¬з—…з–«иӢ—гҖӮ
еҜ№дәҺжҺҘз§ҚдёҖзұ»з–«иӢ—еј•иө·ејӮеёёеҸҚеә”йңҖиҰҒиЎҘеҒҝзҡ„пјҢгҖҠиҚүжЎҲгҖӢжҸҗеҮәпјҢиЎҘеҒҝиҙ№з”Ёз”ұзңҒгҖҒиҮӘжІ»еҢәгҖҒзӣҙиҫ–еёӮдәәж°‘ж”ҝеәңиҙўж”ҝйғЁй—ЁеңЁйў„йҳІжҺҘз§Қе·ҘдҪңз»Ҹиҙ№дёӯе®үжҺ’пјӣе…·дҪ“иЎҘеҒҝеҠһжі•з”ұзңҒгҖҒиҮӘжІ»еҢәгҖҒзӣҙиҫ–еёӮдәәж°‘ж”ҝеәңеҲ¶е®ҡгҖӮ
еј жҖЎжҢҮеҮәпјҢиҝҷе®№жҳ“йҖ жҲҗеҸ‘иҫҫең°еҢәе’ҢиҗҪеҗҺең°еҢәиЎҘеҒҝж ҮеҮҶзҡ„е·ЁеӨ§е·®ејӮпјҢ“еҫҲеӨҡеӯҰиҖ…йғҪи®Өдёәеә”иҜҘз”ұеӣҪеҠЎйҷўеҲ¶е®ҡз»ҹдёҖзҡ„ж ҮеҮҶ”гҖӮ
еҜ№дәҺжҺҘз§ҚдәҢзұ»з–«иӢ—еј•иө·ејӮеёёеҸҚеә”йңҖиҰҒиЎҘеҒҝзҡ„пјҢгҖҠиҚүжЎҲгҖӢжҸҗеҮәпјҢиЎҘеҒҝиҙ№з”Ёз”ұзӣёе…ізҡ„з–«иӢ—дёҠеёӮи®ёеҸҜжҢҒжңүдәәжүҝжӢ…гҖӮеӣҪ家鼓еҠұе»әз«ӢйҖҡиҝҮе•Ҷдёҡдҝқйҷ©зӯүеҪўејҸеҜ№йў„йҳІжҺҘз§ҚејӮеёёеҸҚеә”еҸ—з§ҚиҖ…дәҲд»ҘиЎҘеҒҝзҡ„жңәеҲ¶гҖӮ
“е®һйҷ…дёҠпјҢзҺ°еңЁеҗ„зңҒзҡ„з–ҫз—…йў„йҳІдёҺжҺ§еҲ¶дёӯеҝғйғҪдјҡиҰҒжұӮз–«иӢ—дјҒдёҡжҠ•дҝқгҖӮдҪҶз”ұдәҺеҗ„ең°дёҚеҗҢзҡ„规е®ҡпјҢжҠ•дҝқзҡ„дҝқйҷ©е…¬еҸёд№ҹдёҚеҗҢгҖӮиҝҷж ·зўҺзүҮеҢ–规е®ҡйҖ жҲҗзҡ„з»“жһңе°ұжҳҜпјҢз–«иӢ—дјҒдёҡеҸҜиғҪйңҖиҰҒиҠұиҙ№жӣҙеӨҡзҡ„иҙ№з”ЁеҺ»жҠ•дҝқгҖӮ”еј жҖЎиҜҙгҖӮ
еҸҳеҢ–1
еҲ¶еҒҮе”®еҒҮжңҖй«ҳеӨ„30еҖҚзҪҡж¬ҫ
еҺ»е№ҙ11жңҲгҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢе…¬еёғеҗҺпјҢзӨҫдјҡдёҠеёҢжңӣиҝӣдёҖжӯҘжҸҗй«ҳиҝқжі•зҠҜзҪӘжҲҗжң¬зҡ„е‘јеЈ°йўҮй«ҳгҖӮеңЁз–«иӢ—з®ЎзҗҶжі•иҚүжЎҲе®Ўи®®дёӯпјҢд№ҹжңүеӨҡеҗҚ委е‘ҳи®ӨдёәеӨ„зҪҡеҠӣеәҰдёҚеӨҹпјҢе»әи®®еҠ з Ғжғ©еӨ„зӣёе…іиҝқжі•иЎҢдёәгҖӮ
д»ҺгҖҠиҚүжЎҲгҖӢеҶ…е®№зңӢпјҢиҝҷдёҖе‘јеЈ°еҫ—еҲ°дәҶеӣһеә”гҖӮ
жӯӨеүҚпјҢгҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢжҸҗеҮәпјҢз–«иӢ—дёҠеёӮи®ёеҸҜжҢҒжңүдәәиҝқеҸҚгҖҠиҚҜе“Ғз®ЎзҗҶжі•гҖӢ规е®ҡзҡ„пјҢдҫқз…§зӣёе…іи§„е®ҡд»ҺйҮҚеӨ„зҪҡгҖӮиҚүжЎҲеҲҷеңЁгҖҠиҚҜе“Ғз®ЎзҗҶжі•гҖӢ规е®ҡзҡ„еҹәзЎҖдёҠпјҢиҝӣдёҖжӯҘеҠ еӨ§еҜ№дёҘйҮҚиҝқжі•иЎҢдёәзҡ„еӨ„зҪҡеҠӣеәҰпјҢеҜ№з”ҹдә§гҖҒй”Җе”®еҒҮеҠЈз–«иӢ—зӯүиҝқжі•иЎҢдёәпјҢжҸҗй«ҳзҪҡж¬ҫйҮ‘йўқзҡ„дёӢйҷҗгҖӮ
дҫқжҚ®зҺ°иЎҢгҖҠиҚҜе“Ғз®ЎзҗҶжі•гҖӢпјҢз”ҹдә§й”Җе”®зҡ„иҚҜе“ҒеҰӮжһңеұһдәҺеҒҮиҚҜпјҢ没收иҝқжі•з”ҹдә§гҖҒй”Җе”®зҡ„иҚҜе“Ғе’Ңиҝқжі•жүҖеҫ—пјҢ并еӨ„иҝқжі•з”ҹдә§гҖҒй”Җе”®иҚҜе“Ғиҙ§еҖјйҮ‘йўқдәҢеҖҚд»ҘдёҠдә”еҖҚд»ҘдёӢзҡ„зҪҡж¬ҫпјӣеҰӮжһңеұһдәҺеҠЈиҚҜпјҢ并еӨ„иҝқжі•з”ҹдә§гҖҒй”Җе”®иҚҜе“Ғиҙ§еҖјйҮ‘йўқдёҖеҖҚд»ҘдёҠдёүеҖҚд»ҘдёӢзҡ„зҪҡж¬ҫгҖӮ
еңЁжӯӨеҹәзЎҖдёҠпјҢгҖҠиҚүжЎҲгҖӢжҸҗй«ҳдәҶзҪҡж¬ҫйҮ‘йўқдёӢйҷҗпјҢжҳҺ确规е®ҡпјҢз”ҹдә§гҖҒй”Җе”®зҡ„з–«иӢ—еҰӮжһңеұһдәҺеҒҮиҚҜпјҢ没收иҝқжі•з”ҹдә§гҖҒй”Җе”®зҡ„иҚҜе“Ғе’Ңиҝқжі•жүҖеҫ—пјҢ并еӨ„иҙ§еҖјйҮ‘йўқдә”еҖҚд»ҘдёҠеҚҒеҖҚд»ҘдёӢзҪҡж¬ҫпјҢиҙ§еҖјйҮ‘йўқдёҚи¶і5дёҮе…ғзҡ„пјҢ并еӨ„25дёҮе…ғиҮі50дёҮе…ғзҪҡж¬ҫпјӣжғ…иҠӮдёҘйҮҚзҡ„пјҢеҗҠй”ҖгҖҠиҚҜе“Ғз”ҹдә§и®ёеҸҜиҜҒгҖӢпјҢ并еӨ„иҙ§еҖјйҮ‘йўқеҚҒдә”еҖҚд»ҘдёҠдёүеҚҒеҖҚд»ҘдёӢзҪҡж¬ҫпјҢиҙ§еҖјйҮ‘йўқдёҚи¶і5дёҮе…ғзҡ„пјҢеӨ„100дёҮе…ғиҮі500дёҮе…ғзҪҡж¬ҫгҖӮ
еҰӮжһңз”ҹдә§гҖҒй”Җе”®зҡ„з–«иӢ—еұһдәҺеҠЈиҚҜпјҢзҪҡж¬ҫдёӢйҷҗз”ұзҺ°иЎҢзҡ„“дёҖеҖҚд»ҘдёҠдёүеҖҚд»ҘдёӢ”пјҢжҸҗиҮі“дәҢеҖҚд»ҘдёҠдә”еҖҚд»ҘдёӢ”пјҢиҙ§еҖјйҮ‘йўқдёҚи¶і5дёҮе…ғзҡ„пјҢ并еӨ„10дёҮе…ғд»ҘдёҠ30дёҮе…ғд»ҘдёӢзҪҡж¬ҫпјӣжғ…иҠӮдёҘйҮҚеҲҷеҸҜеӨ„д»Ҙиҝқжі•з”ҹдә§гҖҒй”Җе”®з–«иӢ—иҙ§еҖјйҮ‘йўқеҚҒеҖҚд»ҘдёҠеҚҒдә”еҖҚд»ҘдёӢзҪҡж¬ҫпјҢиҙ§еҖјйҮ‘йўқдёҚи¶і5дёҮе…ғзҡ„пјҢеӨ„50дёҮе…ғд»ҘдёҠ200дёҮе…ғд»ҘдёӢзҪҡж¬ҫгҖӮ
еҸҳеҢ–2
еҲ йҷӨе©ҙе№је„ҝеҸ—иҜ•йҷҗеҲ¶жҖ§и§„е®ҡ
и®°иҖ…жіЁж„ҸеҲ°пјҢгҖҠиҚүжЎҲгҖӢеҲ йҷӨдәҶгҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢдёӯдёҚеҫ—д»Ҙе©ҙе№је„ҝдҪңдёәз–«иӢ—дёҙеәҠиҜ•йӘҢеҸ—иҜ•иҖ…зҡ„规е®ҡгҖӮ
жӯӨеүҚпјҢгҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢжҸҗеҮәпјҢ“з–«иӢ—дёҙеәҠиҜ•йӘҢдёҚеҫ—д»Ҙе©ҙе№је„ҝдҪңдёәеҸ—иҜ•иҖ…пјҢеӣ з ”еҲ¶е©ҙе№је„ҝз–«иӢ—зЎ®йңҖд»Ҙе©ҙе№је„ҝдҪңдёәеҸ—иҜ•иҖ…зҡ„пјҢеә”еҪ“д»ҺжҲҗдәәејҖе§ӢйҖүжӢ©еҸ—иҜ•дәәзҫӨпјҢе®Ўж…ҺйҖүжӢ©еҸ—иҜ•иҖ…пјҢеҗҲзҗҶи®ҫзҪ®еҸ—иҜ•иҖ…зҫӨдҪ“е’Ңе№ҙйҫ„з»„гҖӮ”
гҖҠиҚүжЎҲгҖӢдёӯпјҢиҜҘйғЁеҲҶиЎЁиҝ°ж”№дёәпјҢ“ејҖеұ•з–«иӢ—дёҙеәҠиҜ•йӘҢеә”еҪ“е®Ўж…ҺйҖүжӢ©еҸ—иҜ•иҖ…пјҢеҗҲзҗҶи®ҫзҪ®еҸ—иҜ•иҖ…зҫӨдҪ“е’Ңе№ҙйҫ„з»„гҖӮ”
еҢ—дә¬дёҖ家еӨ§еһӢз–«иӢ—з”ҹдә§дјҒдёҡзӣёе…іиҙҹиҙЈдәәе‘ҠиҜүи®°иҖ…пјҢз–«иӢ—дёҺжІ»з–—жҖ§иҚҜе“Ғзҡ„е·®ејӮеңЁдәҺе®ғжҳҜз»ҷеҒҘеә·дәәдҪҝз”Ёзҡ„пјҢз–«иӢ—еңЁдёҙеәҠеүҚеҠЁзү©иҜ•йӘҢйҳ¶ж®өпјҢе·Із»ҸеҲқжӯҘзЎ®е®ҡдәҶе®үе…ЁжҖ§пјҢеңЁдёҙеәҠиҜ•йӘҢйҳ¶ж®өпјҢдёҖиҲ¬иҜ•йӘҢйЎәеәҸйғҪжҳҜд»ҺжҲҗдәәеҲ°е„ҝз«ҘеҶҚеҲ°е©ҙе№је„ҝпјҢе®үе…ЁжҖ§еҫ—еҲ°еҹәжң¬зЎ®и®ӨжүҚдјҡеңЁе©ҙе№је„ҝиҜ•йӘҢгҖӮ
“иҝҳжңүдәӣз–«иӢ—ж— жі•з»ҷжҲҗдәәжҺҘз§ҚпјҢеҸӘиғҪдҫӣе©ҙе№је„ҝдҪҝз”ЁгҖӮжҜ”еҰӮеҚЎд»ӢиӢ—е°ұжңүжҜ”иҫғдёҘж јзҡ„е№ҙйҫ„йҷҗеҲ¶гҖӮ”д»–иҜҙгҖӮ
з–«иӢ—科жҷ®дё“家йҷ¶й»Һзәіи®ӨдёәпјҢз–«иӢ—дёҚжҳҜжІ»з–—жҖ§иҚҜе“ҒпјҢеүӮйҮҸеҸҚеә”关系并дёҚжҳҜзәҝжҖ§зҡ„пјҢе№ҙйҫ„еӨ§е’Ңе№ҙйҫ„е°ҸеҜ№з–«иӢ—зҡ„жүҝеҸ—еҠӣе…¶е®һжІЎжңүеҢәеҲ«пјҢжүҖд»ҘжІЎеҝ…иҰҒдёҖе®ҡеңЁжҲҗдәәиә«дёҠе…ҲиҜ•йӘҢгҖӮ
еҗҢж—¶пјҢгҖҠиҚүжЎҲгҖӢеҜ№з–«иӢ—дёҙеәҠиҜ•йӘҢдјҰзҗҶе®ЎжҹҘзҺҜиҠӮзҡ„规е®ҡд№ҹиҝӣдёҖжӯҘз»ҶеҢ–гҖӮ
гҖҠеҫҒжұӮж„Ҹи§ҒзЁҝгҖӢжӯӨеүҚжҸҗеҮәпјҢ“ејҖеұ•з–«иӢ—дёҙеәҠиҜ•йӘҢпјҢеә”еҪ“з»ҸдјҰзҗҶ委е‘ҳдјҡе®ЎжҹҘеҗҢж„ҸпјҢз”ұеӣҪеҠЎйҷўиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—Ёе®Ўж ёжү№еҮҶгҖӮ”гҖҠиҚүжЎҲгҖӢеңЁжӯӨеӨ„ж–°еўһ“дјҰзҗҶ委е‘ҳдјҡеә”еҪ“е®ЎжҹҘдёҙеәҠиҜ•йӘҢзҡ„科еӯҰжҖ§е’ҢдјҰзҗҶжҖ§пјҢзӣ‘зқЈдёҙеәҠиҜ•йӘҢ规иҢғејҖеұ•пјҢдҝқжҠӨеҸ—иҜ•иҖ…еҗҲжі•жқғзӣҠгҖӮ”еј жҖЎи®ӨдёәпјҢе…¶е®һиҝҷеңЁзҺ°иЎҢжі•еҫӢ法规дёӯйғҪе·ІжңүжҳҺ确规е®ҡпјҢжӯӨж¬Ўиў«еҗёзәіеҲ°гҖҠиҚүжЎҲгҖӢдёӯжқҘпјҢеҸҜд»ҘеҜ№еҸ—иҜ•иҖ…жқғзӣҠз»ҷдәҲжӣҙе……еҲҶзҡ„дҝқйҡңгҖӮ
еҸҳеҢ–3
дёҫжҠҘдјҒдёҡиҝқжі•иЎҢдёәз»ҷдәҲйҮҚеҘ–
гҖҠиҚүжЎҲгҖӢиҝҳеҗёзәізӨҫдјҡе»әи®®иҝӣиЎҢдәҶеӨҡеӨ„и°ғж•ҙгҖӮ
йҷ¶й»Һзәіжӣҫе»әи®®пјҢе»әз«ӢдјҒдёҡеҶ…йғЁдёҫжҠҘдәәеҘ–еҠұеҲ¶еәҰпјҢиҝҷдёҖе»әи®®дҪ“зҺ°еңЁдәҶгҖҠиҚүжЎҲгҖӢдёӯгҖӮгҖҠиҚүжЎҲгҖӢ第е…ӯеҚҒдёғжқЎжӢҹ规е®ҡпјҢеҜ№дёҫжҠҘз–«иӢ—иҝқжі•иЎҢдёәзҡ„дәәе‘ҳз»ҷдәҲеҘ–еҠұпјҢдёҫжҠҘжүҖеңЁдјҒдёҡжҲ–иҖ…еҚ•дҪҚдёҘйҮҚиҝқжі•зҠҜзҪӘиЎҢдёәзҡ„пјҢз»ҷдәҲйҮҚеҘ–гҖӮ
иҝӣеҮәеҸЈз–«иӢ—д№ҹе°Ҷ“еҶ…еӨ–жңүеҲ«”гҖӮеүҚиҝ°з–«иӢ—з”ҹдә§дјҒдёҡзӣёе…іиҙҹиҙЈдәәе‘ҠиҜүи®°иҖ…пјҢеҫҒжұӮж„Ҹи§ҒзЁҝеҸӘй’ҲеҜ№еӣҪеҶ…з–«иӢ—пјҢ并жңӘжҸҗеҸҠеҮәеҸЈз–«иӢ—пјҢиҖҢеӣҪеҶ…еӨ–еҜ№з–«иӢ—иҰҒжұӮжңүе·®ејӮпјҢеӣ жӯӨдјҒдёҡжӣҫе»әи®®еўһеҠ еҮәеҸЈзӣёе…іеҶ…е®№пјҢд»Ҙе…ҚеҮәеҸЈз–«иӢ—еҸ—иҜёеӨҡдёҚеҝ…иҰҒзҡ„йҷҗеҲ¶гҖӮ
еҜ№жӯӨпјҢгҖҠиҚүжЎҲгҖӢ第е…ӯеҚҒеӣӣжқЎжҳҺзЎ®жҸҗеҮәпјҢеҮәеҸЈзҡ„з–«иӢ—еә”еҪ“з¬ҰеҗҲиҝӣеҸЈеӣҪпјҲең°еҢәпјүзҡ„ж ҮеҮҶд»ҘеҸҠеҗҲеҗҢиҰҒжұӮгҖӮ
з«Ӣжі•ж—¶й—ҙиҪҙ
2018е№ҙ
в—Ҹ7жңҲ
еӣҪ家иҚҜзӣ‘еұҖж №жҚ®зәҝзҙўз»„з»ҮжЈҖжҹҘеҸ‘зҺ°пјҢй•ҝжҳҘй•ҝз”ҹеңЁеҶ»е№Ідәәз”ЁзӢӮзҠ¬з—…з–«иӢ—з”ҹдә§иҝҮзЁӢдёӯеӯҳеңЁи®°еҪ•йҖ еҒҮзӯүдёҘйҮҚиҝқеҸҚгҖҠиҚҜе“Ғз”ҹдә§иҙЁйҮҸз®ЎзҗҶ规иҢғгҖӢиЎҢдёәгҖӮ
в—Ҹ10жңҲ
еӣҪ家иҚҜзӣ‘еұҖе’Ңеҗүжһ—зңҒйЈҹиҚҜзӣ‘еұҖеҲҶеҲ«еҜ№й•ҝжҳҘй•ҝз”ҹе…¬еҸёдҪңеҮәеӨҡйЎ№иЎҢж”ҝеӨ„зҪҡгҖӮ
в—Ҹ11жңҲ11ж—Ҙ
гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢејҖе§ӢдёәжңҹеҚҠдёӘжңҲзҡ„еҫҒжұӮж„Ҹи§ҒгҖӮ
в—Ҹ11жңҲ25ж—Ҙ
гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүгҖӢеҫҒжұӮж„Ҹи§Ғз»“жқҹгҖӮ
в—Ҹ11жңҲдёӢж—¬
гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲиҚүжЎҲйҖҒе®ЎзЁҝпјүгҖӢжҠҘйҖҒеӣҪеҠЎйҷўгҖӮ
в—Ҹ12жңҲ23ж—Ҙ
еҚҒдёүеұҠе…ЁеӣҪдәәеӨ§еёёе§”дјҡ第дёғж¬Ўдјҡи®®пјҢгҖҠз–«иӢ—з®ЎзҗҶжі•пјҲиҚүжЎҲпјүгҖӢйҰ–ж¬ЎжҸҗиҜ·е®Ўи®®гҖӮ
2019е№ҙ
в—Ҹ1жңҲ4ж—Ҙ
гҖҠз–«иӢ—з®ЎзҗҶжі•пјҲиҚүжЎҲпјүгҖӢе…¬ејҖеҫҒжұӮж„Ҹи§ҒгҖӮ
в—Ҹ2жңҲ3ж—Ҙ
е…¬ејҖеҫҒжұӮж„Ҹи§Ғз»“жқҹгҖӮ
з–«иӢ—иЎҢдёҡеҸ‘еұ•з»ҷдәәзұ»зӨҫдјҡеёҰжқҘе·ЁеӨ§зҡ„з»ҸжөҺе’ҢзӨҫдјҡж•ҲзӣҠпјҢеҗҢж—¶еӨ§е№…иҠӮзңҒз–ҫз—…жІ»з–—иҙ№з”ЁгҖӮдёӯеӣҪд»Һе»әеӣҪејҖе§Ӣе°ұйқһеёёйҮҚи§Ҷе…Қ疫规еҲ’пјҢдёӯеӣҪе…Қ疫规еҲ’з–«иӢ—жү©ж•°йҮҸд№ҹд»Һе»әеӣҪ70е№ҙд»Јзҡ„4з§Қжү©еўһиҮізҺ°д»Ҡзҡ„15з§ҚпјҲзҷҫзҷҪз ҙгҖҒеҚЎд»ӢиӢ—гҖҒйә»з–№гҖҒи„Ҡй«“зҒ°иҙЁзӮҺгҖҒд№ҷиӮқгҖҒзҷҪз ҙгҖҒз”ІиӮқгҖҒжөҒи„‘гҖҒд№ҷи„‘гҖҒйә»и…®йЈҺпјҲйә»йЈҺгҖҒйә»и…®гҖҒйә»з–№пјүгҖҒеҮәиЎҖзғӯгҖҒзӮӯз–Ҫе’Ңй’©з«Ҝиһәж—ӢдҪ“з–«иӢ—пјүгҖӮ
еңЁжҲ‘еӣҪпјҢж №жҚ®д»ҳиҙ№жғ…еҶөпјҢз–«иӢ—еҲҶдёәдёҖзұ»з–«иӢ—е’ҢдәҢзұ»з–«иӢ—гҖӮ
第дёҖзұ»з–«иӢ— пјҲ 规е®ҡејәе…Қз–«иӢ—пјүпјҢжҳҜжҢҮж”ҝеәңе…Қиҙ№еҗ‘е…¬ж°‘жҸҗдҫӣпјҢе…¬ж°‘еә”еҪ“дҫқз…§ж”ҝеәңзҡ„规е®ҡеҸ—з§Қзҡ„з–«иӢ—пјҢеҢ…жӢ¬еӣҪ家е…Қ疫规еҲ’зЎ®е®ҡзҡ„з–«иӢ—пјҢзңҒгҖҒиҮӘжІ»еҢәгҖҒзӣҙиҫ–еёӮдәәж°‘ж”ҝеәңеңЁжү§иЎҢеӣҪ家е…Қ疫规еҲ’ж—¶еўһеҠ зҡ„з–«иӢ—пјҢд»ҘеҸҠеҺҝзә§д»ҘдёҠдәәж°‘ж”ҝеәңжҲ–иҖ…е…¶еҚ«з”ҹдё»з®ЎйғЁй—Ёз»„з»Үзҡ„еә”жҖҘжҺҘз§ҚжҲ–иҖ…зҫӨдҪ“жҖ§йў„йҳІжҺҘз§ҚжүҖдҪҝз”Ёзҡ„з–«иӢ—гҖӮ
第дәҢзұ»з–«иӢ—пјҲи®ЎеҲ’еӨ–з–«иӢ—пјүжҳҜжҢҮз”ұе…¬ж°‘иҮӘиҙ№е№¶дё”иҮӘж„ҝеҸ—з§Қзҡ„е…¶д»–з–«иӢ—пјҢ家й•ҝеҸҜж №жҚ®е„ҝз«ҘиҮӘиә«жғ…еҶөгҖҒең°еҢәеҸҠз»ҸжөҺзҠ¶еҶөеҶіе®ҡгҖӮеҰӮжһңйҖүжӢ©жіЁе°„第дәҢзұ»з–«иӢ—еә”еңЁдёҚеҪұе“Қ第дёҖзұ»з–«иӢ—жғ…еҶөдёӢиҝӣиЎҢйҖүжӢ©жҖ§жіЁе°„пјҢжҺҘз§ҚиҝҮжҙ»з–«иӢ—пјҲйә»з–№з–«иӢ—гҖҒд№ҷи„‘з–«иӢ—гҖҒи„ҠзҒ°зі–дёёпјүиҰҒй—ҙйҡ” 4 е‘ЁжүҚиғҪжҺҘз§Қжӯ»з–«иӢ—пјҲзҷҫзҷҪз ҙгҖҒд№ҷиӮқгҖҒжөҒи„‘еҸҠжүҖжңү第дәҢзұ»з–«иӢ—пјүгҖӮ
дёҖзұ»з–«иӢ—еӣҪ家еһ„ж–ӯпјҢж”ҝеәңж”Ҝд»ҳпјҢдё»иҰҒжҺҘз§ҚеҜ№иұЎдёәе„ҝз«ҘпјҢеёӮеңәиў«еӣҪдјҒеһ„ж–ӯпјҢеҲ©ж¶Ұз©әй—ҙе°ҸпјҢжңӘжқҘеўһй•ҝжңүйҷҗпјҢиў«еӣҪ家жҠҠжҺ§пјӣдәҢзұ»з–«иӢ—е®һиЎҢдјҒдёҡиҮӘдё»е®ҡд»·пјҢеҲ©ж¶Ұз©әй—ҙеӨ§пјҢеёӮеңәз«һдәүжҝҖзғҲгҖӮеӨҡж•°з–«иӢ—з”ЁдәҺжҺҘз§Қе©ҙе№је„ҝпјҢдё”е…¶з ”еҸ‘гҖҒз”ҹдә§дёҖиҲ¬е’Ңз»ҶиҸҢгҖҒз—…жҜ’зӣёе…іпјҢе®үе…ЁиҰҒжұӮй«ҳдәҺдёҖиҲ¬иҚҜе“ҒпјҢеӣ жӯӨж•ҙдёӘз–«иӢ—иЎҢдёҡд»Һз ”еҸ‘гҖҒз”ҹдә§еҲ°жөҒйҖҡгҖҒй”Җе”®е’Ңе”®еҗҺеҸҚйҰҲзҺҜиҠӮеҸ—еҲ°йқһеёёдёҘж јзҡ„зӣ‘з®ЎгҖӮ
2017е№ҙ,з–«иӢ—жү№зӯҫйҮҸдёә7.12дәҝд»ҪгҖӮе…¶дёӯдёҖзұ»з–«иӢ—жү№зӯҫеҸ‘зҡ„дё»иҰҒжңүжөҒи„‘гҖҒд№ҷи„‘гҖҒзҷҫзҷҪз ҙгҖҒд№ҷиӮқгҖҒйә»йЈҺи…®гҖҒи„ҠзҒ°гҖҒеҚЎд»ӢиӢ—гҖҒз”ІиӮқзӯүз–«иӢ—,дәҢзұ»з–«иӢ—зӯҫеҸ‘зҡ„дё»иҰҒзӢӮзҠ¬гҖҒжөҒж„ҹгҖҒHibгҖҒж°ҙз—ҳзӯүз–«иӢ—гҖӮ
2010-2017е№ҙдёӯеӣҪз–«иӢ—зӯҫеҸ‘йҮҸжғ…еҶө
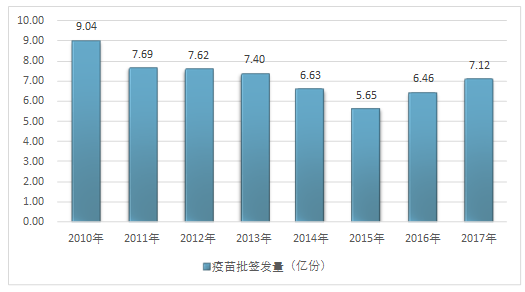
иө„ж–ҷжқҘжәҗпјҡдёӯеӣҪйЈҹе“ҒиҚҜе“ҒжЈҖе®ҡз ”з©¶йҷў
дәҢзұ»з–«иӢ—жү№зӯҫеҸ‘еҚ жҜ”20%гҖӮйҡҸзқҖжҲ‘еӣҪдәәеқҮз»ҸжөҺж¶Ҳиҙ№иғҪеҠӣзҡ„жҸҗй«ҳ,е…·жңүй«ҳжҠҖжңҜеҗ«йҮҸгҖҒй«ҳд»·ж јзү№зӮ№зҡ„дәҢзұ»з–«иӢ—и¶ҠжқҘи¶Ҡиў«еӨ§дј—жүҖжҺҘеҸ—,еӣҪеҶ…дәҢзұ»иӢ—зҡ„жҜ”дҫӢеңЁ2010-2015е№ҙжңҹй—ҙеҫ—еҲ°жҸҗй«ҳ,д»Һ2010е№ҙзҡ„14.43%дёҠеҚҮеҲ°дәҶ2015е№ҙзҡ„20.74%,иҝ‘еҮ е№ҙжқҘиҜҘжҜ”дҫӢдёҖзӣҙзЁіе®ҡеңЁ20%е·ҰеҸігҖӮ
2012-2017е№ҙдёӯеӣҪжҲ‘еӣҪз–«иӢ—жү№зӯҫеҸ‘ж•°йҮҸ
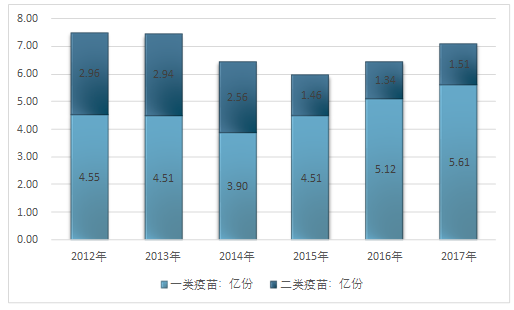
иө„ж–ҷжқҘжәҗпјҡдёӯеӣҪйЈҹе“ҒиҚҜе“ҒжЈҖе®ҡз ”з©¶йҷў
жҲ‘еӣҪжҳҜдё–з•ҢдёҠз–«иӢ—дә§йҮҸйўҶе…Ҳзҡ„еӣҪ家пјҢд№ҹжҳҜдё–з•ҢдёҠз–«иӢ—з”ҹдә§дјҒдёҡж•°йҮҸжңҖеӨҡзҡ„еӣҪ家д№ӢдёҖпјҢзӣ®еүҚжңүз–«иӢ—з”ҹдә§дјҒдёҡи¶…иҝҮ30家пјҢеҢ…жӢ¬дёӯеӣҪз”ҹзү©жҠҖжңҜиӮЎд»Ҫжңүйҷҗе…¬еҸёгҖҒдёӯеӣҪеҢ»еӯҰ科еӯҰйҷўеҢ»еӯҰз”ҹзү©еӯҰз ”з©¶жүҖзӯүеӣҪжңүдјҒдёҡе’Ңеә·жі°з”ҹзү©гҖҒжҷәйЈһз”ҹзү©гҖҒжІғжЈ®з”ҹзү©гҖҒеҚҺе…°з”ҹзү©зӯүж°‘иҗҘдјҒдёҡпјҢеӨ–иө„дјҒдёҡеҰӮи‘ӣе…°зҙ еҸІе…ӢгҖҒй»ҳжІҷдёңгҖҒиөӣиҜәиҸІ•е·ҙж–Ҝеҫ·зӯүд№ҹеҚ жңүдёҖе®ҡзҡ„еёӮеңәд»ҪйўқгҖӮйҡҸзқҖеӣҪ家ж”ҝзӯ–еҜ№з–«иӢ—иЎҢдёҡзҡ„еӨ§еҠӣжү¶жҢҒгҖҒеұ…ж°‘еҸҜж”Ҝй…Қ收е…Ҙзҡ„еўһй•ҝе’ҢйҳІз—…ж„ҸиҜҶзҡ„дёҚж–ӯеўһејәгҖҒз–«иӢ—з ”еҸ‘е’Ңз”ҹдә§жҠ•е…ҘдёҚж–ӯеўһеҠ гҖҒдә§е“ҒйҖҗжӯҘеҚҮзә§жҚўд»ЈпјҢеӣҪеҶ…з–«иӢ—дә§дёҡе°ҶиҺ·еҫ—й«ҳйҖҹеўһй•ҝгҖӮ
2017е№ҙпјҢжҷәйЈһз”ҹзү©гҖҒеә·жі°з”ҹзү©зӯүе…¬еҸёдёҡз»©еўһй•ҝжҳҺжҳҫгҖӮе…¶дёӯпјҢжҷәйЈһз”ҹзү©еҮҖеҲ©ж¶Ұжҡҙж¶Ё12еҖҚгҖӮжІғжЈ®з”ҹзү©еҲҷйҷ·е…Ҙе·ЁйўқдәҸжҚҹгҖӮдёҚиҝҮпјҢе…¶иҮӘдё»з–«иӢ—дә§е“ҒжүҖиҙЎзҢ®зҡ„еҮҖеҲ©ж¶Ұеўһй•ҝжҳҺжҳҫгҖӮ
2017е№ҙдёӯеӣҪз–«иӢ—йғЁеҲҶдјҒдёҡз–«иӢ—дә§е“Ғй”Җ售规模
дјҒдёҡ | 2017е№ҙз–«иӢ—й”Җ售收е…Ҙпјҡдәҝе…ғ |
жҷәйЈһз”ҹзү© | 12.63 |
еә·жі°з”ҹзү© | 11.59 |
жІғжЈ®з”ҹзү© | 5.15 |
иө„ж–ҷжқҘжәҗпјҡе…¬еҸёе№ҙжҠҘ
дҪңдёәдё–з•ҢдёҠжңҖеӨ§зҡ„з–«иӢ—з”ҹдә§еӣҪпјҢжҲ‘еӣҪиғҪеӨҹдҫқйқ иҮӘиә«иғҪеҠӣи§ЈеҶіе…ЁйғЁе…Қз–«дҫӣеә”е’Ңз–«иӢ—жҺҘз§ҚгҖӮдҪҶжҳҜжҲ‘еӣҪзҡ„з–«иӢ—дә§дёҡеңЁдё–з•ҢиҢғеӣҙеҶ…并дёҚз®—ејәеӨ§пјҢиҝ‘дәӣе№ҙжқҘиЎҢдёҡзҡ„еёӮеңәеўһйҖҹд№ҹйҖҗжёҗж”ҫзј“гҖӮ
2009-2017е№ҙжҲ‘еӣҪдәәз”Ёз–«иӢ—иҝӣеҸЈжғ…еҶө
е№ҙд»Ҫ | еҮәеҸЈж•°йҮҸ пјҲеҚғе…Ӣпјү | иҝӣеҸЈж•°йҮҸ пјҲеҚғе…Ӣпјү | еҮәеҸЈйҮ‘йўқ пјҲеҚғзҫҺе…ғпјү | иҝӣеҸЈйҮ‘йўқ пјҲеҚғзҫҺе…ғпјү |
2009е№ҙ | 81,078 | 293,199 | 19,157 | 196,443 |
2010е№ҙ | 98,354 | 458,200 | 26,172 | 228,120 |
2011е№ҙ | 93,980 | 229,177 | 20,457 | 190,399 |
2012е№ҙ | 90,968 | 177,337 | 22,128 | 155,745 |
2013е№ҙ | 110,324 | 294,225 | 39,417 | 303,673 |
2014е№ҙ | 159,567 | 210,948 | 39,584 | 187,307 |
2015е№ҙ | 152,046 | 173,916 | 47,151 | 217,600 |
2016е№ҙ | 145516 | 134083 | 63936 | 239058 |
2017е№ҙ | 154594 | 174619 | 68092 | 311400 |
иө„ж–ҷжқҘжәҗпјҡдёӯеӣҪжө·е…і
ж №жҚ®дё–з•ҢеҚ«з”ҹз»„з»Үз»ҹи®ЎпјҢеҚ е…ЁзҗғдәәеҸЈ60%зҡ„дәҡжҙІзӣ®еүҚд»…ж¶ҲиҖ—13%зҡ„дәәз”Ёз–«иӢ—е’Ң20%зҡ„е…Ҫз”Ёз–«иӢ—пјҢиҖҢжҲ‘еӣҪеұ…ж°‘зҡ„з–«иӢ—жҺҘз§ҚзҺҮз”ҡиҮідҪҺдәҺдәҡжҙІе№іеқҮж°ҙе№іпјҢд»ҘжөҒж„ҹз–«иӢ—дёәдҫӢпјҢжҲ‘еӣҪзҡ„жҺҘз§ҚзҺҮдёҚеҲ°2%пјҢиҖҢ欧зҫҺеҸ‘иҫҫеӣҪ家жҺҘз§ҚзҺҮжҷ®йҒҚиҫҫеҲ°дәҶ20%пҪһ30%пјҢеҠ жӢҝеӨ§жӣҙжҳҜиҫҫеҲ°дәҶ45%зҡ„жҺҘз§ҚзҺҮпјҢдёҺ欧зҫҺеҸ‘иҫҫеӣҪ家зӣёжҜ”пјҢдёӯеӣҪз–«иӢ—еёӮеңәжӢҘжңүеҫҲеӨ§зҡ„еҸ‘еұ•жҪңеҠӣгҖӮе…¶дёӯпјҢдәҢзұ»з–«иӢ—жӣҙжҳҜиў«еҜ„дәҲеҺҡжңӣгҖӮе°Ҫз®Ўзӣ®еүҚеңЁдёӯеӣҪиҮӘж„ҝжҺҘз§ҚдәҢзұ»з–«иӢ—зҡ„йңҖжұӮйҮҸиҝҳиҝңе°‘дәҺе…Қ疫规еҲ’з”Ёзҡ„дёҖзұ»з–«иӢ—пјҢдҪҶйҡҸзқҖе…¬дј—еҜ№йў„йҳІзҡ„е…іжіЁеәҰжҸҗеҚҮгҖҒеӣҪ家新еҢ»ж”№з»§з»ӯеҠ еӨ§еҜ№йў„йҳІеҢ»з–—зҡ„жҠ•е…ҘпјҢжңӘжқҘе°ҶжңүжӣҙеӨҡзҡ„з–«иӢ—зәіе…Ҙи®ЎеҲ’е…Қз–«пјҢзҺ°жңүзҡ„дәҢзұ»з–«иӢ—зҡ„еёӮеңәжңүжңӣеҝ«йҖҹеҸ‘еұ•гҖӮ
 жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ
жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ

2024-2030е№ҙдёӯеӣҪжөҒиЎҢжҖ§ж„ҹеҶ’з–«иӢ—иЎҢдёҡеҸ‘еұ•еҠЁжҖҒеҸҠжҠ•иө„规еҲ’еҲҶжһҗжҠҘе‘Ҡ
гҖҠ2024-2030е№ҙдёӯеӣҪжөҒиЎҢжҖ§ж„ҹеҶ’з–«иӢ—иЎҢдёҡеҸ‘еұ•еҠЁжҖҒеҸҠжҠ•иө„规еҲ’еҲҶжһҗжҠҘе‘ҠгҖӢе…ұеҚҒеӣӣз« гҖӮйҰ–е…Ҳд»Ӣз»ҚдәҶж— дәәжҺҘй©іиҪҰиЎҢдёҡеёӮеңәеҸ‘еұ•гҖӢе…ұеҚҒеӣӣз« пјҢеҢ…еҗ«2024-2030е№ҙжөҒиЎҢжҖ§ж„ҹеҶ’з–«иӢ—иЎҢдёҡжҠ•иө„жңәдјҡдёҺйЈҺйҷ©пјҢжөҒиЎҢжҖ§ж„ҹеҶ’з–«иӢ—иЎҢдёҡжҠ•иө„жҲҳз•Ҙз ”з©¶пјҢз ”з©¶з»“и®әеҸҠжҠ•иө„е»әи®®зӯүеҶ…е®№гҖӮ
зүҲжқғжҸҗзӨәпјҡжҷәз ”е’ЁиҜўеҖЎеҜје°ҠйҮҚдёҺдҝқжҠӨзҹҘиҜҶдә§жқғпјҢеҜ№жңүжҳҺзЎ®жқҘжәҗзҡ„еҶ…е®№жіЁжҳҺеҮәеӨ„гҖӮеҰӮеҸ‘зҺ°жң¬з«ҷж–Үз« еӯҳеңЁзүҲжқғгҖҒзЁҝй…¬жҲ–е…¶е®ғй—®йўҳпјҢзғҰиҜ·иҒ”зі»жҲ‘们пјҢжҲ‘们е°ҶеҸҠж—¶дёҺжӮЁжІҹйҖҡеӨ„зҗҶгҖӮиҒ”зі»ж–№ејҸпјҡgaojian@chyxx.comгҖҒ010-60343812гҖӮ






