дёҖгҖҒж”ҝзӯ–еҠЁжҖҒ
иЎҢдёҡйӣҶдёӯеёҰйҮҸйҮҮиҙӯзӣёе…іж”ҝзӯ–
пјҲдёҖпјүеӣҪ家еұӮйқў
еҠЁжҖҒ1пјҡ7жңҲ11ж—ҘпјҢеӣҪ家组з»Үй«ҳеҖјеҢ»з”ЁиҖ—жқҗиҒ”еҗҲйҮҮиҙӯеҠһе…¬е®ӨйўҒеёғгҖҠеӣҪ家组з»ҮйӘЁз§‘и„Ҡжҹұзұ»иҖ—жқҗйӣҶдёӯеёҰйҮҸйҮҮиҙӯе…¬е‘ҠгҖӢпјҢзЎ®е®ҡз”ұеӨ©жҙҘеёӮеҢ»иҚҜйҮҮиҙӯдёӯеҝғжүҝжӢ…иҒ”еҗҲйҮҮиҙӯеҠһе…¬е®Өж—Ҙеёёе·ҘдҪң并иҙҹиҙЈе…·дҪ“е®һж–ҪпјҢжң¬ж¬ЎйӣҶдёӯеёҰйҮҸйҮҮиҙӯдә§е“ҒдёәйӘЁз§‘и„Ҡжҹұзұ»еҢ»з”ЁиҖ—жқҗпјҢж №жҚ®жүӢжңҜзұ»еһӢгҖҒжүӢжңҜйғЁдҪҚгҖҒе…Ҙи·Ҝж–№ејҸзӯүз»„е»әдә§е“Ғзі»з»ҹиҝӣиЎҢйҮҮиҙӯпјҢе…ұеҲҶдёә14дёӘдә§е“Ғзі»з»ҹзұ»еҲ«гҖӮ
еҠЁжҖҒ2пјҡ7жңҲ27ж—ҘпјҢеӣҪ家组з»Үй«ҳеҖјеҢ»з”ЁиҖ—жқҗиҒ”еҗҲйҮҮиҙӯеҠһе…¬е®ӨеҸ‘еёғгҖҠе…ідәҺејҖеұ•и„Ҡжҹұзұ»иҖ—жқҗеҢ»з–—жңәжһ„йҮҮиҙӯйңҖжұӮеЎ«жҠҘе·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҢе…¬еёғдәҶжң¬ж¬Ўи„Ҡжҹұзұ»иҖ—жқҗеёҰйҮҸйҮҮиҙӯзҡ„йңҖжұӮеЎ«жҠҘе“Ғз§ҚгҖҒеЎ«жҠҘж—¶й—ҙгҖҒеЎ«жҠҘж–№ејҸд»ҘеҸҠеЎ«жҠҘиҰҒжұӮгҖӮжң¬ж¬ЎеЎ«жҠҘе“Ғз§ҚдёәйӘЁз§‘и„Ҡжҹұзұ»еҢ»з”ЁиҖ—жқҗпјҢеҢ…жӢ¬14дёӘдә§е“Ғзі»з»ҹзұ»еҲ«пјҢеЎ«жҠҘж—¶й—ҙдёә2022е№ҙ8жңҲ1ж—Ҙ12ж—¶вҖ”8жңҲ14ж—Ҙ17ж—¶пјҢжң¬ж¬Ўж•°жҚ®еЎ«жҠҘйҮҮз”ЁзәҝдёҠзӣҙжҠҘж–№ејҸпјҢйҖҡиҝҮеӣҪ家组з»ҮеҢ»з”ЁиҖ—жқҗиҒ”еҗҲйҮҮиҙӯе№іеҸ°пјҢеңЁдјҒдёҡзЎ®е®ҡз”іжҠҘзҡ„дә§е“Ғзі»з»ҹдёӯйҖүжӢ©жң¬еҚ•дҪҚдёҙеәҠйңҖиҰҒзҡ„дә§е“Ғзі»з»ҹпјҢ并填жҠҘжҜҸдёӘдә§е“Ғзі»з»ҹжңӘжқҘдёҖе№ҙзҡ„йңҖжұӮйҮҸгҖӮ
пјҲдәҢпјүең°ж–№еұӮйқў
еҠЁжҖҒ3пјҡ7жңҲ24ж—ҘпјҢж·ұеңіеёӮеҸ‘еұ•е’Ңж”№йқ©е§”е‘ҳдјҡе…ідәҺеҚ°еҸ‘гҖҠж·ұеңіеёӮдҝғиҝӣз”ҹзү©еҢ»иҚҜдә§дёҡйӣҶзҫӨй«ҳиҙЁйҮҸеҸ‘еұ•зҡ„иӢҘе№ІжҺӘж–ҪгҖӢгҖҠж·ұеңіеёӮдҝғиҝӣй«ҳз«ҜеҢ»з–—еҷЁжў°дә§дёҡйӣҶзҫӨй«ҳиҙЁйҮҸеҸ‘еұ•зҡ„иӢҘе№ІжҺӘж–ҪгҖӢгҖҠж·ұеңіеёӮдҝғиҝӣеӨ§еҒҘеә·дә§дёҡйӣҶзҫӨй«ҳиҙЁйҮҸеҸ‘еұ•зҡ„иӢҘе№ІжҺӘж–ҪгҖӢзӯүдёүдёӘж”ҝзӯ–жҺӘж–Ҫзҡ„йҖҡзҹҘпјҢе…¶дёӯпјҢгҖҠж·ұеңіеёӮдҝғиҝӣй«ҳз«ҜеҢ»з–—еҷЁжў°дә§дёҡйӣҶзҫӨй«ҳиҙЁйҮҸеҸ‘еұ•зҡ„иӢҘе№ІжҺӘж–ҪгҖӢжҳҫзӨәпјҢдёәеҠ еӨ§еҲӣж–°дә§е“Ғеә”з”ЁзӨәиҢғпјҢж”ҜжҢҒеҢ»з–—еҷЁжў°дјҒдёҡзәіе…ҘеёҰйҮҸйҮҮиҙӯгҖӮйј“еҠұдјҒдёҡз§ҜжһҒеҸӮеҠ еӣҪ家еҢ»з–—еҷЁжў°йӣҶдёӯеёҰйҮҸйҮҮиҙӯжӢ“еұ•еёӮеңәпјҢдёӯж Үе“Ғз§ҚжҢүеҪ“е№ҙйҮҮиҙӯжҖ»йҮ‘йўқзҡ„3%дәҲд»Ҙиө„еҠ©пјҢеҚ•дёӘе“Ғз§Қиө„еҠ©жңҖй«ҳдёҚи¶…иҝҮ300дёҮе…ғпјҢеҚ•дёӘдјҒдёҡжҜҸе№ҙиө„еҠ©жңҖй«ҳдёҚи¶…иҝҮ500дёҮе…ғгҖӮ
еҠЁжҖҒ4пјҡ7жңҲ12ж—ҘпјҢеұұиҘҝдёҙжұҫеёӮеҢ»дҝқеұҖеҸ‘еёғгҖҠиҝҗеҹҺгҖҒдёҙжұҫгҖҒй•ҝжІ»гҖҒжҷӢеҹҺеӣӣеёӮиҒ”зӣҹ第е…ӯиҪ®еҢ»з”ЁиҖ—жқҗеёҰйҮҸйҮҮиҙӯйЎ№зӣ®з«һд»·и°ҲеҲӨдёӯйҖүе…¬е‘ҠгҖӢгҖӮе…ұи¶…3800дёҮдёӘиҖ—жқҗдә§е“ҒдёӯйҖүпјҢе…ЁйғЁдёәеӣҪдә§дјҒдёҡгҖӮжң¬ж¬ЎйҮҮиҙӯйЎ№зӣ®е…ұ7еҢ…пјҢеҢ…жӢ¬дёҖж¬ЎжҖ§йә»йҶүз©ҝеҲәеҘ—件пјҲзЎ¬иҶңеӨ–е’Ңи…°жӨҺиҒ”еҗҲйә»йҶүз©ҝеҲәеҘ—件пјүгҖҒж©Ўиғ¶жЈҖжҹҘжүӢеҘ—гҖҒPEжЈҖжҹҘжүӢеҘ—гҖҒдёҖж¬ЎжҖ§жүӢжңҜиЎЈгҖҒеҢ»з”Ёз”ҹзү©зЈҒжҖ§ж•·иҙҙпјҲж°ёзЈҒж„ҲеҗҲиҙҙпјүгҖҒдёҖж¬ЎжҖ§дҪҝз”Ёдә§еҢ…гҖҒдёҖж¬ЎжҖ§дҪҝз”ЁжүӢжңҜеҢ…гҖӮжҚ®жӮүпјҢз¬ҰеҗҲиҰҒжұӮзҡ„дҫӣеә”е•ҶеҸҜеҸӮдёҺе…Ӣд»·и°ҲеҲӨзҡ„еҚ•еҢ…жҲ–иҖ…еӨҡеҢ…пјҢдҪҶжүҖз«һд»·еҢ…еҸ·еҶ…жүҖжңүйЎ№зӣ®еҶ…е®№гҖҒи§„ж јгҖҒеһӢеҸ·еҝ…йЎ»е®Ңе…Ёе“Қеә”жң¬з«һд»·и°ҲеҲӨж–Ү件жүҖеҲ—зӨәеҶ…е®№гҖӮ
еҠЁжҖҒ5пјҡ7жңҲ28ж—ҘпјҢж№–еҚ—ж ӘжҙІиҒ”зӣҹеҢ»иҚҜйӣҶдёӯйҷҗд»·йҮҮиҙӯе№іеҸ°еҸ‘еёғгҖҠе…ідәҺйӮҖиҜ·з”іжҠҘж№–еҚ—зңҒдҪҺеҖјеҢ»з”ЁиҖ—жқҗеёҰйҮҸйҮҮиҙӯдјҒдёҡдә§е“Ғиө„ж–ҷзҡ„йҖҡзҹҘгҖӢгҖӮжҚ®йҖҡзҹҘпјҢж№–еҚ—жӢҹеңЁе…ЁзңҒејҖеұ•дҪҺеҖјиҖ—жқҗеёҰйҮҸйҮҮиҙӯпјҢдә§е“ҒиҢғеӣҙиҰҶзӣ–дёҖж¬ЎжҖ§дҪҝз”ЁйӣҫеҢ–еҗёе…ҘеҷЁгҖҒдёҖж¬ЎжҖ§дҪҝз”ЁйҒҝе…үиҫ“ж¶ІеҷЁгҖҒж— иҸҢж•·иҙҙпјҲз•ҷзҪ®й’Ҳдё“з”ЁпјүгҖҒдёҖж¬ЎжҖ§дҪҝз”Ёзңҹз©әйҮҮиЎҖз®ЎгҖҒдёҖж¬ЎжҖ§йј»ж°§з®ЎпјҲеёҰж№ҝеҢ–пјүгҖҒдёҖж¬ЎжҖ§дҪҝз”ЁеҢ»з”Ёе–үзҪ©гҖҒеҢ»з”Ёй«ҳеҲҶеӯҗеӨ№жқҝпјҲйӘЁз§‘пјүгҖҒеҢ»з”Ёй«ҳеҲҶеӯҗз»·еёҰпјҲйӘЁз§‘пјүгҖӮ2021е№ҙд»ҘжқҘеңЁж№–еҚ—зңҒе…¬ з«ӢеҢ»з–—жңәжһ„й”Җе”®зӣёе…ідә§е“Ғзҡ„дјҒдёҡйңҖдәҺ8жңҲ7ж—Ҙ17:00еүҚеЎ«жҠҘзӣёе…ідҝЎжҒҜгҖӮ
еҠЁжҖҒ6пјҡиҝ‘ж—Ҙ пјҢз”ұжұҹиҘҝзүөеӨҙзҡ„иӮқеҠҹз”ҹеҢ–иҜ•еүӮиҒ”зӣҹйҮҮиҙӯжӯЈејҸејҖеұ•пјҢ жң¬ж¬Ў21зңҒеёӮеҢ…жӢ¬пјҡ жұҹиҘҝзңҒгҖҒжІіеҢ—зңҒгҖҒйҷ•иҘҝзңҒгҖҒеҶ…и’ҷеҸӨиҮӘжІ»еҢәгҖҒиҫҪе®ҒзңҒгҖҒеҗүжһ—зңҒгҖҒй»‘йҫҷжұҹзңҒгҖҒзҰҸе»әзңҒгҖҒжІіеҚ—зңҒгҖҒж№–еҢ—зңҒгҖҒж№–еҚ—зңҒгҖҒе№ҝдёңзңҒгҖҒе№ҝиҘҝеЈ®ж—ҸиҮӘжІ»еҢәгҖҒжө·еҚ—зңҒгҖҒйҮҚеәҶеёӮгҖҒиҙөе·һзңҒгҖҒйҷ•иҘҝзңҒгҖҒз”ҳиӮғзңҒгҖҒйқ’жө·зңҒгҖҒе®ҒеӨҸеӣһж—ҸиҮӘжІ»еҢәгҖҒж–°з–Ҷз»ҙеҗҫе°”иҮӘжІ»еҢәгҖҒж–°з–Ҷз”ҹдә§е»әи®ҫе…өеӣўгҖӮ
еҠЁжҖҒ7пјҡиҝ‘ж—ҘпјҢж №жҚ®еҗүжһ—зңҒеҢ»дҝқеұҖгҖҠе…ідәҺжү§иЎҢдә¬жҙҘеҶҖвҖң3+NвҖқиҒ”зӣҹйӘЁз§‘еҲӣдјӨзұ»еҢ»з”ЁиҖ—жқҗеёҰйҮҸиҒ”еҠЁдёӯйҖүз»“жһңзҡ„йҖҡзҹҘгҖӢиҰҒжұӮпјҢ8жңҲ1ж—ҘејҖе§Ӣжү§иЎҢйӘЁз§‘еҲӣдјӨзұ»еҢ»з”ЁиҖ—жқҗеёҰйҮҸйҮҮиҙӯз»“жһңпјҢеұҠж—¶жҲ‘дёӯеҝғе°Ҷи°ғж•ҙдёӯйҖүдә§е“ҒзҪ‘дёҠйҮҮиҙӯд»·ж јгҖӮиҜ·еҗ„зӣёе…іеҢ»з–—жңәжһ„еңЁ8жңҲ1ж—ҘеүҚз»ҙжҠӨеҘҪеҲӣдјӨзұ»иҖ—жқҗдә§е“ҒйҮҮиҙӯдҝЎжҒҜпјҢе®Ңе–„е№іеҸ°йҮҮиҙӯжөҒзЁӢпјҢдёәйҒҝе…ҚеҮәзҺ°жү§иЎҢеёҰйҮҸз»“жһңеүҚйҮҮиҙӯзҡ„дә§е“Ғеӣ 延иҝҹз»ҙжҠӨдҝЎжҒҜйҖ жҲҗд»·ж јеҲҶжӯ§зҺ°иұЎгҖӮ
2гҖҒиЎҢдёҡжіЁеҶҢдёҺе®ЎжҹҘзӣёе…іж”ҝзӯ–
пјҲдёҖпјүеӣҪ家еұӮйқў
еҠЁжҖҒ8пјҡеӣҪ家иҚҜзӣ‘еұҖеҸ‘еёғгҖҠе…ідәҺејҖеұ•жё…зҗҶ规иҢғеҢ»з–—еҷЁжў°жіЁеҶҢе·ҘдҪңзҡ„йҖҡзҹҘгҖӢ
7жңҲ11ж—ҘпјҢдёәиҗҪе®һ2002е№ҙе…ЁеӣҪеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶе·ҘдҪңдјҡи®®зІҫзҘһпјҢдёҘж јеҢ»з–—еҷЁжў°дёҠеёӮе®Ўжү№пјҢд»ҺжәҗеӨҙдёҠзЎ®дҝқеёӮеңәеҮҶе…ҘеҢ»з–—еҷЁжў°зҡ„е®үе…Ёжңүж•ҲпјҢеӣҪ家иҚҜзӣ‘еұҖеҶіе®ҡе°ұеҢ»з–—еҷЁжў°зҡ„жіЁеҶҢжғ…еҶөпјҢиҝӣиЎҢе…Ёйқўзҡ„жё…зҗҶ规иҢғгҖӮеўғеҶ…第дёүзұ»еҢ»з–—еҷЁжў°е’ҢиҝӣеҸЈеҢ»з–—еҷЁжў°жіЁеҶҢжғ…еҶөзҡ„жё…зҗҶпјҢз”ұеӣҪ家иҚҜзӣ‘еұҖеҢ»з–—еҷЁжў°еҸёиҙҹиҙЈпјҢеўғеҶ…第дәҢзұ»д»ҘдёӢпјҲеҗ«з¬¬дәҢзұ»пјүеҢ»з–—еҷЁжў°жіЁеҶҢжғ…еҶөзҡ„жё…зҗҶпјҢз”ұеҗ„зңҒгҖҒиҮӘжІ»еҢәгҖҒзӣҙиҫ–еёӮиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖиҙҹиҙЈгҖӮ
еҠЁжҖҒ9пјҡеӣҪ家иҚҜзӣ‘еұҖеҢ»з–—еҷЁжў°ж ҮеҮҶз®ЎзҗҶдёӯеҝғеҸ‘еёғгҖҠ2022е№ҙеҢ»з–—еҷЁжў°еҲҶзұ»з•Ңе®ҡз»“жһңжұҮжҖ»гҖӢ
жң¬ж¬ЎжұҮжҖ»зҡ„2022е№ҙ1жңҲ-2022е№ҙ6жңҲеҢ»з–—еҷЁжў°дә§е“ҒеҲҶзұ»з•Ңе®ҡз»“жһңе…ұ369дёӘпјҡе»әи®®жҢүз…§в…ўзұ»еҢ»з–—еҷЁжў°з®ЎзҗҶзҡ„дә§е“Ғ106дёӘпјҢе»әи®®жҢүз…§в…Ўзұ»еҢ»з–—еҷЁжў°з®ЎзҗҶзҡ„дә§е“Ғ108дёӘпјҢе»әи®®жҢүз…§Iзұ»еҢ»з–—еҷЁжў°з®ЎзҗҶзҡ„дә§е“Ғ90дёӘпјӣжҢүз…§гҖҠеҢ»з–—еҷЁжў°еҲҶзұ»зӣ®еҪ•еҠЁжҖҒи°ғж•ҙе·ҘдҪңзЁӢеәҸгҖӢпјҢеўғеҶ…еҢ»з–—еҷЁжў°жіЁеҶҢдәәе’ҢеӨҮжЎҲдәәгҖҒз”ҹдә§з»ҸиҗҘдјҒдёҡгҖҒдҪҝз”ЁеҚ•дҪҚеҸҜд»Ҙеҗ‘жүҖеңЁзңҒпјҲеҢәгҖҒеёӮпјүиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁжҸҗеҮәгҖҠеҲҶзұ»зӣ®еҪ•гҖӢи°ғж•ҙе»әи®®пјӣеўғеӨ–еҢ»з–—еҷЁжў°жіЁеҶҢдәәе’ҢеӨҮжЎҲдәәеҸҜд»Ҙ委жүҳе…¶еўғеҶ…д»ЈзҗҶдәәпјҢеҗ‘е…¶д»ЈзҗҶдәәжүҖеңЁзңҒпјҲеҢәгҖҒеёӮпјүиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁжҸҗеҮәгҖҠеҲҶзұ»зӣ®еҪ•гҖӢи°ғж•ҙе»әи®®гҖӮ
еҠЁжҖҒ10пјҡиҚҜзӣ‘еұҖеҸ‘еёғгҖҠеҢ»з–—еҷЁжў°еҲҶзұ»зӣ®еҪ•гҖӢ8дёӘеӯҗзӣ®еҪ•зӣёе…ідә§е“ҒдёҙеәҠиҜ„д»·жҺЁиҚҗи·Ҝеҫ„
7жңҲ14ж—ҘпјҢдёәиҝӣдёҖжӯҘжҢҮеҜјжіЁеҶҢз”іиҜ·дәәзЎ®е®ҡе…·дҪ“дә§е“Ғзҡ„дёҙеәҠиҜ„д»·и·Ҝеҫ„пјҢеҷЁе®ЎдёӯеҝғжҢүз…§гҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢзҡ„жңү关规е®ҡпјҢж №жҚ®гҖҠеҶізӯ–жҳҜеҗҰејҖеұ•еҢ»з–—еҷЁжў°дёҙеәҠиҜ•йӘҢжҠҖжңҜжҢҮеҜјеҺҹеҲҷгҖӢзӯү规иҢғиҰҒжұӮпјҢеҹәдәҺзӣ®еүҚзҡ„е®ЎиҜ„з»ҸйӘҢд»ҘеҸҠгҖҠеҢ»з–—еҷЁжў°еҲҶзұ»зӣ®еҪ•гҖӢдёӯзҡ„еӯҗзӣ®еҪ•01вҖңжңүжәҗжүӢжңҜеҷЁжў°вҖқгҖҒ04вҖңйӘЁз§‘жүӢжңҜеҷЁжў°вҖқгҖҒ07вҖңеҢ»з”ЁиҜҠеҜҹе’Ңзӣ‘жҠӨеҷЁжў°вҖқгҖҒ08вҖңе‘јеҗёгҖҒйә»йҶүе’ҢжҖҘж•‘еҷЁжў°вҖқгҖҒ09вҖңзү©зҗҶжІ»з–—еҷЁжў°вҖқгҖҒ10вҖңиҫ“иЎҖгҖҒйҖҸжһҗе’ҢдҪ“еӨ–еҫӘзҺҜеҷЁжў°вҖқгҖҒ19вҖңеҢ»з”Ёеә·еӨҚеҷЁжў°вҖқгҖҒ21вҖңеҢ»з”ЁиҪҜ件вҖқзҡ„дә§е“ҒжҸҸиҝ°гҖҒйў„жңҹз”ЁйҖ”е’Ңе“ҒеҗҚдёҫдҫӢпјҢжҸҗеҮәе…·дҪ“дә§е“ҒдёҙеәҠиҜ„д»·зҡ„жҺЁиҚҗи·Ҝеҫ„гҖӮ
пјҲдәҢпјүең°ж–№еұӮйқў
еҠЁжҖҒ11пјҡеӣӣе·қзңҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҸ‘еёғгҖҠеӣӣе·қзңҒ第дәҢзұ»еҢ»з–—еҷЁжў°еә”жҖҘе®Ўжү№зЁӢеәҸгҖӢ
7жңҲ28ж—ҘпјҢдёәжңүж•Ҳйў„йҳІгҖҒеҸҠж—¶жҺ§еҲ¶е’Ңж¶ҲйҷӨзӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件зҡ„еҚұе®іпјҢзЎ®дҝқзӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件еә”жҖҘжүҖйңҖеҢ»з–—еҷЁжў°е°Ҫеҝ«е®ҢжҲҗе®Ўжү№пјҢж №жҚ®жҲ‘еӣҪзӣёе…іжі•и§„гҖҒи§„з« е’Ң规иҢғжҖ§ж–Ү件пјҢеӣӣе·қзңҒиҚҜзӣ‘еұҖеҲ¶е®ҡ并еҸ‘еёғгҖҠеӣӣе·қзңҒ第дәҢзұ»еҢ»з–—еҷЁжў°еә”жҖҘе®Ўжү№зЁӢеәҸгҖӢпјҢйҖӮз”ЁдәҺзӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件еә”жҖҘжүҖйңҖпјҢдё”еңЁзңҒеҶ…е°ҡж— еҗҢзұ»дә§е“ҒдёҠеёӮпјҢжҲ–иҷҪеңЁзңҒеҶ…е·ІжңүеҗҢзұ»дә§е“ҒдёҠеёӮпјҢдҪҶдә§е“Ғдҫӣеә”дёҚиғҪж»Ўи¶ізӘҒеҸ‘е…¬е…ұеҚ«з”ҹдәӢ件еә”жҖҘеӨ„зҗҶйңҖиҰҒпјҢ并з»ҸзңҒиҚҜзӣ‘еұҖзЎ®и®Өзҡ„зңҒеҶ…第дәҢзұ»еҢ»з–—еҷЁжў°зҡ„жіЁеҶҢе®Ўжү№гҖӮ
еҠЁжҖҒ12пјҡдёҠжө·еёӮиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖе…ідәҺдјҳеҢ–第дәҢзұ»еҢ»з–—еҷЁжў°е»¶з»ӯжіЁеҶҢз”іжҠҘж–№ејҸзәҫеӣ°жғ дјҒзҡ„йҖҡе‘Ҡ
7жңҲ22ж—ҘпјҢдёәжӣҙеҘҪиҗҪе®һеёӮж”ҝеәңе…ідәҺеҠ еҝ«з»ҸжөҺжҒўеӨҚе’ҢйҮҚжҢҜиЎҢеҠЁж–№жЎҲзІҫзҘһпјҢиҝӣдёҖжӯҘзәҫеӣ°жғ дјҒгҖҒдёҘе®ҲеҢ»з–—еҷЁжў°иҙЁйҮҸе®үе…ЁпјҢзҺ°еҜ№жң¬еёӮ第дәҢзұ»еҢ»з–—еҷЁжў°е»¶з»ӯжіЁеҶҢпјҲд»ҘдёӢз®Җ称延з»ӯжіЁеҶҢпјүз”іжҠҘж–№ејҸеҸҠжөҒзЁӢзӯүиҰҒжұӮиҝӣиЎҢдјҳеҢ–и°ғж•ҙ
3гҖҒиЎҢдёҡзӣ‘зқЈдёҺз®ЎзҗҶзӣёе…іж”ҝзӯ–
пјҲдёҖпјүеӣҪ家еұӮйқў
еҠЁжҖҒ13пјҡ7жңҲ8еҸ·пјҢеӣҪ家еҢ»дҝқеұҖдјҡеҗҢиҙўж”ҝйғЁгҖҒеӣҪ家зЁҺеҠЎжҖ»еұҖе…ұеҗҢеҚ°еҸ‘гҖҠе…ідәҺеҒҡеҘҪ2022е№ҙеҹҺд№Ўеұ…ж°‘еҹәжң¬еҢ»з–—дҝқйҡңе·ҘдҪңзҡ„йҖҡзҹҘгҖӢгҖӮж №жҚ®гҖҠйҖҡзҹҘгҖӢиҰҒжұӮпјҢе®Ңе–„еҢ»дҝқеҢ»з”ЁиҖ—жқҗе’ҢеҢ»з–—жңҚеҠЎйЎ№зӣ®з®ЎзҗҶгҖӮеҠ ејәиҚҜе“ҒиҖ—жқҗйӣҶдёӯеёҰйҮҸйҮҮиҙӯе’Ңд»·ж јз®ЎзҗҶпјҡиҰҒе…Ёж–№дҪҚгҖҒеӨҡеұӮж¬ЎжҺЁиҝӣиҚҜе“ҒгҖҒеҢ»з”ЁиҖ—жқҗйӣҶйҮҮе·ҘдҪңпјҢз»ҹзӯ№еҚҸи°ғејҖеұ•еӣҪ家组з»Үе’ҢзңҒйҷ…иҒ”зӣҹйӣҶйҮҮгҖӮ2022е№ҙеә•еӣҪ家е’ҢзңҒзә§пјҲжҲ–и·ЁзңҒиҒ”зӣҹпјүйӣҶйҮҮиҚҜе“Ғе“Ғз§Қж•°зҙҜи®ЎдёҚе°‘дәҺ350дёӘпјҢй«ҳеҖјеҢ»з”ЁиҖ—жқҗе“Ғз§ҚзҙҜи®ЎиҫҫеҲ°5дёӘд»ҘдёҠгҖӮеҗҜеҠЁеҢ»иҚҜд»·ж јзӣ‘жөӢе·ҘзЁӢпјҢзј–еҲ¶еҢ»иҚҜд»·ж јжҢҮж•°пјҢејәеҢ–иҚҜе“Ғе’ҢеҢ»з”ЁиҖ—жқҗд»·ж јеёёжҖҒеҢ–зӣ‘з®ЎпјҢжҢҒз»ӯжҺЁиҝӣеҢ»иҚҜд»·ж је’ҢжӢӣйҮҮдҝЎз”ЁиҜ„д»·еҲ¶еәҰе®һж–ҪгҖӮ
еҠЁжҖҒ14пјҡ7жңҲ12ж—ҘпјҢеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҢ»з–—еҷЁжў°жҠҖжңҜе®ЎиҜ„дёӯеҝғеҸ‘еёғгҖҠе…ідәҺеҢ»з–—еҷЁе®үе…Ёе’ҢжҖ§иғҪеҹәжң¬еҺҹеҲҷз¬ҰеҗҲжҖ§жҠҖжңҜжҢҮеҚ—гҖӢзҡ„йҖҡе‘ҠпјҢжқҘиҝӣдёҖжӯҘжҢҮеҜјжіЁеҶҢз”іиҜ·дәә科еӯҰеҗҲзҗҶең°иҝҗз”ЁIMDRF第дёүзүҲгҖҠеҢ»з–—еҷЁжў°е®үе…Ёе’ҢжҖ§иғҪеҹәжң¬еҺҹеҲҷгҖӢиҝӣиЎҢдә§е“Ғз ”еҸ‘е’ҢжіЁеҶҢз”іжҠҘпјҢзЎ®дҝқеҢ»з–—еҷЁжў°е®үе…Ёжңүж•ҲгҖӮгҖҠжҢҮеҚ—гҖӢдёәжҸҗдҫӣжіЁеҶҢз”іиҜ·дәәе’Ңе®ЎжҹҘдәәе‘ҳдҪҝз”Ёзҡ„жҢҮеҜјжҖ§ж–Ү件пјҢдёҚж¶үеҸҠжіЁеҶҢе®Ўжү№зӯүиЎҢж”ҝдәӢйЎ№пјҢдәҰдёҚдҪңдёә法规ејәеҲ¶жү§иЎҢпјҢеҰӮжңүиғҪеӨҹ满足法规иҰҒжұӮзҡ„е…¶д»–ж–№жі•пјҢд№ҹеҸҜйҮҮз”ЁпјҢдҪҶеә”жҸҗдҫӣиҜҰз»Ҷзҡ„з ”з©¶иө„ж–ҷгҖӮ
еҠЁжҖҒ15пјҡ7жңҲ18еҸ·пјҢдёәеҠ ејәеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶпјҢдҝқйҡңеҢ»з–—еҷЁжў°дә§е“ҒиҙЁйҮҸе®үе…Ёжңүж•ҲпјҢеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖз»„з»ҮеҜ№жүӢжңҜиЎЈгҖҒдёҖж¬ЎжҖ§дҪҝз”Ёи…№йғЁз©ҝеҲәеҷЁгҖҒе°ҸеһӢи’ёжұҪзҒӯиҸҢеҷЁзӯү3дёӘе“Ғз§ҚиҝӣиЎҢдәҶдә§е“ҒиҙЁйҮҸзӣ‘зқЈжҠҪжЈҖпјҢеҸ‘зҺ°4жү№пјҲеҸ°пјүдә§е“ҒдёҚз¬ҰеҗҲж ҮеҮҶ规е®ҡгҖӮиҰҒжұӮеҢ»з–—еҷЁжў°жіЁеҶҢдәәжүҖеңЁең°зңҒзә§иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁжҢүз…§гҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢгҖҠеҢ»з–—еҷЁжў°з”ҹдә§зӣ‘зқЈз®ЎзҗҶеҠһжі•гҖӢгҖҠеҢ»з–—еҷЁжў°еҸ¬еӣһз®ЎзҗҶеҠһжі•гҖӢзӯүиҰҒжұӮпјҢеҸҠж—¶дҪңеҮәиЎҢж”ҝеӨ„зҗҶеҶіе®ҡ并еҗ‘зӨҫдјҡе…¬еёғгҖӮзңҒзә§иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁиҰҒзқЈдҝғеҢ»з–—еҷЁжў°жіЁеҶҢдәәеҜ№жҠҪжЈҖдёҚз¬ҰеҗҲж ҮеҮҶ规е®ҡзҡ„дә§е“ҒиҝӣиЎҢйЈҺйҷ©иҜ„дј°пјҢж №жҚ®еҢ»з–—еҷЁжў°зјәйҷ·зҡ„дёҘйҮҚзЁӢеәҰзЎ®е®ҡеҸ¬еӣһзә§еҲ«пјҢдё»еҠЁеҸ¬еӣһдә§е“Ғ并公ејҖеҸ¬еӣһдҝЎжҒҜпјӣзқЈдҝғдјҒдёҡе°Ҫеҝ«жҹҘжҳҺдә§е“ҒдёҚеҗҲж јеҺҹеӣ пјҢеҲ¶е®ҡж•ҙж”№жҺӘж–Ҫ并жҢүжңҹж•ҙж”№еҲ°дҪҚгҖӮ
еҠЁжҖҒ16пјҡ7жңҲ26ж—ҘпјҢеӣҪ家еҢ»дҝқеұҖеҸҠиҙўж”ҝйғЁиҒ”еҗҲеҸ‘еёғгҖҠе…ідәҺиҝӣдёҖжӯҘеҒҡеҘҪеҹәжң¬еҢ»з–—дҝқйҷ©и·ЁзңҒејӮең°е°ұеҢ»зӣҙжҺҘз»“з®—е·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҢеҸӮдҝқдәәе‘ҳи·ЁзңҒејӮең°е°ұеҢ»зӣҙжҺҘз»“з®—дҪҸйҷўгҖҒжҷ®йҖҡй—ЁиҜҠе’Ңй—ЁиҜҠж…ўзү№з—…еҢ»з–—иҙ№з”Ёж—¶пјҢеҺҹеҲҷдёҠжү§иЎҢе°ұеҢ»ең°и§„е®ҡзҡ„ж”Ҝд»ҳиҢғеӣҙеҸҠжңү关规е®ҡпјҲеҹәжң¬еҢ»з–—дҝқйҷ©иҚҜе“ҒгҖҒеҢ»з–—жңҚеҠЎйЎ№зӣ®е’ҢеҢ»з”ЁиҖ—жқҗзӯүж”Ҝд»ҳиҢғеӣҙпјүпјӣи·ЁзңҒејӮең°е°ұеҢ»еҸ‘з”ҹзҡ„еҢ»з–—иҙ№з”Ёз”ұе°ұеҢ»ең°з»ҸеҠһжңәжһ„жҢүз…§е°ұеҢ»ең°зҡ„еҹәжң¬еҢ»з–—дҝқйҷ©иҚҜе“ҒгҖҒеҢ»з–—жңҚеҠЎйЎ№зӣ®е’ҢеҢ»з”ЁиҖ—жқҗзӯүж”Ҝд»ҳиҢғеӣҙиҝӣиЎҢиҙ№з”Ёе®Ўж ёпјҢеҜ№еҸ‘з”ҹзҡ„дёҚз¬ҰеҗҲ规е®ҡзҡ„еҢ»з–—иҙ№з”ЁжҢүе°ұеҢ»ең°еҢ»дҝқжңҚеҠЎеҚҸи®®зәҰе®ҡдәҲд»ҘжүЈйҷӨгҖӮ
еҠЁжҖҒ17пјҡ 7жңҲ19ж—ҘпјҢеӣҪ家еҢ»з–—дҝқйҡңеұҖеҠһе…¬е®ӨеҸ‘еёғгҖҠе…ідәҺиҝӣдёҖжӯҘеҒҡеҘҪеҢ»з–—жңҚеҠЎд»·ж јз®ЎзҗҶе·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҢеҜ№д»Ҙж–°и®ҫеӨҮж–°иҖ—жқҗжҲҗжң¬дёәдё»гҖҒд»·ж јйў„жңҹиҫғй«ҳзҡ„д»·ж јйЎ№зӣ®пјҢеҒҡеҘҪеҲӣж–°жҖ§гҖҒз»ҸжөҺжҖ§иҜ„д»·гҖӮе®Ўж…ҺеҜ№еҫ…иө„жң¬иҰҒзҙ й©ұеҠЁгҖҒеҚ•зәҜи°ӢжұӮжҠ•иө„еӣһжҠҘеҸҠең°ж–№дҝқжҠӨзү№еҫҒзҡ„з«ӢйЎ№иҜүжұӮпјҢйҒҝе…ҚжҢүзү№е®ҡи®ҫеӨҮгҖҒиҖ—жқҗгҖҒеҸ‘жҳҺдәәгҖҒжҠҖжңҜжөҒжҙҫзӯүиҰҒзҙ и®ҫз«Ӣе…·жңүжҺ’д»–жҖ§зҡ„еҢ»з–—жңҚеҠЎд»·ж јйЎ№зӣ®гҖӮжҳҺзЎ®еҢ»з–—жңҚеҠЎд»·ж је’ҢиҚҜе“ҒиҖ—жқҗйӣҶдёӯйҮҮиҙӯеҗ„иҮӘзҡ„еҠҹиғҪе®ҡдҪҚпјҢд»·ж ји°ғж•ҙи§ҰеҸ‘жңәеҲ¶дёҺиҚҜе“ҒиҖ—жқҗйӣҶдёӯйҮҮиҙӯдёҚзӣҙжҺҘжҢӮй’©пјҢи°ғж•ҙжҖ»йҮҸдёҚзӣҙжҺҘ平移зҪ®жҚўгҖӮеҜ№еҢ»з”ЁиҖ—жқҗе’ҢеҢ»з–—жңҚеҠЎж·ұеәҰе…іиҒ”зҡ„йЎ№зӣ®пјҢиҰҒеҮҶзЎ®еҲҶжһҗйӣҶдёӯйҮҮиҙӯдә§з”ҹзҡ„е…·дҪ“еҪұе“ҚпјҢеҲҶзұ»ж–Ҫзӯ–гҖҒ科еӯҰеҚҸеҗҢгҖӮ
еҠЁжҖҒ18пјҡ7жңҲ12ж—ҘпјҢдёәиҝӣдёҖжӯҘжҢҮеҜјжіЁеҶҢз”іиҜ·дәә科еӯҰеҗҲзҗҶең°иҝҗ用第дёүзүҲгҖҠеҢ»з–—еҷЁжў°е®үе…Ёе’ҢжҖ§иғҪеҹәжң¬еҺҹеҲҷгҖӢиҝӣиЎҢдә§е“Ғз ”еҸ‘е’ҢжіЁеҶҢз”іжҠҘпјҢзЎ®дҝқеҢ»з–—еҷЁжў°е®үе…Ёжңүж•ҲпјҢеӣҪ家иҚҜзӣ‘еұҖеҷЁе®ЎдёӯеҝғеҹәдәҺеҪ“еүҚи®ӨзҹҘж°ҙе№іе’Ңе®ЎиҜ„е·ҘдҪңе®һйҷ…жғ…еҶөпјҢз»„з»Үзј–еҶҷдәҶгҖҠ<еҢ»з–—еҷЁжў°е®үе…Ёе’ҢжҖ§иғҪеҹәжң¬еҺҹеҲҷ>з¬ҰеҗҲжҖ§жҠҖжңҜжҢҮеҚ—гҖӢ
пјҲдәҢпјүең°ж–№еұӮйқў
еҠЁжҖҒ19пјҡ7жңҲ26ж—ҘпјҢж·ұеңіеҮәеҸ°дҝғиҝӣй«ҳз«ҜеҢ»з–—еҷЁжў°еҸ‘еұ•ж”ҝзӯ–гҖҠж·ұеңіеёӮдҝғиҝӣй«ҳз«ҜеҢ»з–—еҷЁжў°дә§дёҡйӣҶзҫӨй«ҳиҙЁйҮҸеҸ‘еұ•зҡ„иӢҘе№ІжҺӘж–ҪгҖӢдёӯжҸҗеҸҠж”ҜжҢҒйўҶеҹҹж¶өзӣ–еҢ»еӯҰеҪұеғҸгҖҒдҪ“еӨ–иҜҠж–ӯгҖҒй«ҳеҖјиҖ—жқҗгҖҒеҹәеӣ жЈҖжөӢгҖҒжүӢжңҜжңәеҷЁдәәзӯүз»ҶеҲҶйўҶеҹҹгҖӮгҖҠйҖҡзҹҘгҖӢзҡ„еҚ°еҸ‘жңүеҲ©дәҺеҠ еҝ«еҹ№иӮІжң¬ең°й«ҳз«ҜеҢ»з–—еҷЁжў°дә§дёҡйӣҶзҫӨпјҢеҲҮе®һжҠўеҚ ж–°дёҖиҪ®дә§дёҡеҸ‘еұ•зҡ„еҲ¶й«ҳзӮ№пјҢеўһејәжң¬ең°дә§дёҡж ёеҝғз«һдәүеҠӣгҖӮ
еҠЁжҖҒ20пјҡ7жңҲ1ж—ҘпјҢиҙөе·һзңҒиҚҜе“Ғзӣ‘з®ЎеұҖдёәи®ӨзңҹиҙҜеҪ»иҗҪе®һж–°дҝ®и®ўе®һж–Ҫзҡ„гҖҠеҢ»з–—еҷЁжў°зӣ‘зқЈз®ЎзҗҶжқЎдҫӢгҖӢеҸҠе…¶й…ҚеҘ—法规пјҢжҢҒз»ӯжҺЁиҝӣеҢ»з–—еҷЁжў°е®ЎиҜ„е®Ўжү№еҲ¶еәҰж”№йқ©пјҢеқҡжҢҒеҲӣж–°еҸ‘еұ•пјҢжҺЁиҝӣвҖңж”ҫз®ЎжңҚвҖқж”№йқ©пјҢдјҳеҢ–жҲ‘зңҒе®ЎиҜ„е®Ўжү№жөҒзЁӢпјҢиҝӣдёҖжӯҘжҸҗй«ҳе®ЎиҜ„е®Ўжү№ж•ҲзҺҮпјҢжҺЁеҠЁжҲ‘зңҒеҢ»з–—еҷЁжў°дә§дёҡй«ҳиҙЁйҮҸеҸ‘еұ•пјҢеҚ°еҸ‘дәҶгҖҠе…ідәҺдјҳеҢ–иҙөе·һзңҒ第дәҢзұ»еҢ»з–—еҷЁжў°е®ЎиҜ„е®Ўжү№зҡ„иӢҘе№ІжҺӘж–ҪгҖӢзҡ„йҖҡзҹҘгҖӮ
еҠЁжҖҒ21пјҡ7жңҲ11ж—ҘпјҢжө·еҚ—зңҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҸ‘еёғгҖҠиҝӣдёҖжӯҘеҠ ејәйӣҶдёӯеёҰйҮҸйҮҮиҙӯдёӯйҖүеҢ»з–—еҷЁжў°дә§е“ҒиҙЁйҮҸзӣ‘з®Ўе·ҘдҪңзҡ„йҖҡзҹҘгҖӢпјҢеҠ ејәйӣҶдёӯеёҰйҮҸйҮҮиҙӯдёӯйҖүеҢ»з–—еҷЁжў°дә§е“Ғе·ҘдҪңиҙЁйҮҸзӣ‘з®ЎпјҢеҲҮе®һз»ҙжҠӨе…¬дј—з”Ёжў°е®үе…ЁпјҢеҒҡеҘҪйӣҶдёӯеёҰйҮҸйҮҮиҙӯдёӯйҖүеҢ»з–—еҷЁжў°дә§е“ҒиҙЁйҮҸзӣ‘з®Ўе·ҘдҪңпјҢзү№еҲ«жҳҜжө·еҚ—зңҒйӣҶйҮҮдёӯйҖүдә§е“ҒжӨҚе…ҘејҸеҝғи„Ҹиө·жҗҸеҷЁгҖҒи…”й•ңеҗ»еҗҲеҷЁгҖҒйқҷи„үз•ҷзҪ®й’Ҳзҡ„зӣ‘зқЈз®ЎзҗҶгҖӮ
еҠЁжҖҒ22пјҡ7жңҲ27ж—ҘпјҢе№ҝдёңзңҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҸ‘еёғгҖҠе№ҝдёңзңҒиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖеҢ»з–—еҷЁжў°жіЁеҶҢдәәгҖҒеӨҮжЎҲдәә延伸жЈҖжҹҘз®ЎзҗҶ规е®ҡгҖӢпјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүпјҢд»ҘжӯӨдҝқиҜҒеҢ»з–—еҷЁжў°иҙЁйҮҸе®үе…ЁпјҢдҝқйҡңдәәдҪ“еҒҘеә·е’Ңз”ҹе‘Ҫе®үе…ЁпјҢдҝғиҝӣеҢ»з–—еҷЁжў°дә§дёҡеҸ‘еұ•гҖӮгҖҠ规е®ҡгҖӢжүҖ称延伸жЈҖжҹҘжҳҜжҢҮиҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—Ёдёәз»јеҗҲиҜ„д»·еҢ»з–—еҷЁжў°жіЁеҶҢдәәгҖҒеӨҮжЎҲдәәиҙЁйҮҸз®ЎзҗҶдҪ“зі»з¬ҰеҗҲжҖ§е’Ңжңүж•ҲжҖ§пјҢеҜ№дёәеҢ»з–—еҷЁжў°зҡ„з ”еҲ¶гҖҒз”ҹдә§зӯүжҙ»еҠЁжҸҗдҫӣдә§е“ҒжҲ–жңҚеҠЎзҡ„еҚ•дҪҚеҸҠдёӘдәәејҖеұ•зҡ„жЈҖжҹҘжҙ»еҠЁгҖӮгҖҠ规е®ҡгҖӢйҖӮз”ЁдәҺе№ҝдёңзңҒеҗ„зә§иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶйғЁй—ЁејҖеұ•зҡ„еҢ»з–—еҷЁжў°йўҶеҹҹ延伸жЈҖжҹҘжҙ»еҠЁгҖӮ
еҠЁжҖҒ23пјҡ7жңҲ29ж—ҘпјҢе®үеҫҪиҚҜзӣ‘еұҖеҸ‘еёғгҖҠе®үеҫҪзңҒиҚҜе“Ғе’ҢеҢ»з–—еҷЁжў°дҪҝз”Ёзӣ‘зқЈз®ЎзҗҶеҠһжі•гҖӢпјҢеҹәжң¬е»әз«ӢиҰҶзӣ–иҚҜжў°еҰҶзӣ‘з®Ўе…ЁйўҶеҹҹгҖҒеҗ„зҺҜиҠӮзҡ„зӣ‘з®ЎеҲ¶еәҰдҪ“зі»гҖӮеҜ№е®үеҫҪиЎҖж¶ІеҲ¶е“ҒгҖҒз”ҹзү©еҲ¶е“ҒгҖҒеӨ§е®№йҮҸжіЁе°„еүӮгҖҒеӣҪ家йӣҶйҮҮдёӯйҖүиҚҜе“Ғе’Ң第дёүзұ»еҢ»з–—еҷЁжў°зӯүйҮҚзӮ№дә§е“Ғз”ҹдә§дјҒдёҡпјҢзү№ж®ҠиҚҜе“Ғз”ҹдә§з»ҸиҗҘдјҒдёҡе®һж–Ҫе№ҙеәҰе…ЁиҰҶзӣ–зӣ‘зқЈжЈҖжҹҘгҖӮе…ұжҹҘеӨ„иҚҜжў°еҢ–иҝқжі•жЎҲ件4388件пјҢеҗҢжҜ”еўһй•ҝ54.8%пјҢе®һзҺ°жЎҲ件жҹҘеӨ„ж•°йҮҸгҖҒиҙЁйҮҸвҖңеҸҢжҸҗеҚҮвҖқпјҢзӣ‘з®Ўй’ҲеҜ№жҖ§е’Ңе®һж•ҲжҖ§жҳҫи‘—еўһејәгҖӮ
4гҖҒиЎҢдёҡеҸ‘еұ•дёҺж”ҜжҢҒзӣёе…іж”ҝзӯ–
еҠЁжҖҒ24пјҡ7жңҲ8ж—ҘпјҢдёәеҠ еҝ«жҺЁиҝӣй«ҳз«ҜеҢ»з–—иЈ…еӨҮеҸ‘еұ•еә”з”ЁпјҢе·Ҙдёҡе’ҢдҝЎжҒҜеҢ–йғЁгҖҒеӣҪ家еҚ«з”ҹеҒҘеә·е§”иҒ”еҗҲиө·иҚүдәҶгҖҠй«ҳз«ҜеҢ»з–—иЈ…еӨҮеә”з”ЁзӨәиҢғеҹәең°з®ЎзҗҶеҠһжі•пјҲиҜ•иЎҢпјүгҖӢпјҲеҫҒжұӮж„Ҹи§ҒзЁҝпјүпјҢж„Ҹи§ҒжҸҗеҮәпјҢзӨәиҢғеҹәең°е»әи®ҫпјҢз”ұең°ж–№ж”ҝеәңзүөеӨҙз»„з»ҮзҹҘеҗҚеҢ»з–—жңәжһ„гҖҒз§‘з ”жңәжһ„гҖҒз”ҹдә§дјҒдёҡгҖҒжЈҖжөӢжңәжһ„зӯүеҗҲдҪңпјҢжҺўзҙўе»әз«ӢеҒҘе…ЁеҢ»з–—иЈ…еӨҮд»ҺжҠҖжңҜејҖеҸ‘гҖҒдә§е“Ғз”ҹдә§гҖҒзӨәиҢғйӘҢиҜҒеҲ°еә”з”ЁжҺЁе№ҝзҡ„еҲӣж–°дҪ“зі»пјҢиҗҘйҖ еҢ…жӢ¬ж”ҝзӯ–гҖҒйҮ‘иһҚгҖҒзӣ‘з®ЎгҖҒеӯҰ科дәӨеҸүгҖҒеҢ»з–—зӨәиҢғзӯүдәҺдёҖдҪ“зҡ„жҝҖеҠұдә§дёҡеҲӣж–°еҸ‘еұ•зҡ„з”ҹжҖҒзҺҜеўғпјҢеҪўжҲҗдё»еҜјдә§е“Ғзү№иүІйІңжҳҺгҖҒеҲӣж–°иҰҒзҙ й«ҳеәҰйӣҶиҒҡгҖҒзҪ‘з»ңеҚҸдҪңзҙ§еҜҶй«ҳж•ҲгҖҒдә§дёҡз”ҹжҖҒдҪ“зі»е®Ңе–„зҡ„еҢ»з–—иЈ…еӨҮеҲ¶йҖ дёҡйӣҶиҒҡеҢәгҖӮ
дәҢгҖҒжҠ•иһҚиө„еҠЁжҖҒ
жҚ®ITжЎ”еӯҗж•°жҚ®пјҢ2022е№ҙ7жңҲпјҢдёӯеӣҪеӣҪеҶ…еҢ»з–—еҷЁжў°иЎҢдёҡзҙҜи®Ўдә§з”ҹ30иө·иһҚиө„йЎ№зӣ®пјҢе…¶дёӯдҪ“еӨ–иҜҠж–ӯзұ»йЎ№зӣ®9иө·пјҢеҝғиӮәиЎҖз®Ўзұ»йЎ№зӣ®5иө·пјҢжүӢжңҜжңәеҷЁдәәзұ»йЎ№зӣ®2иө·пјҢдәәдҪ“еҷЁе®ҳзұ»йЎ№зӣ®2иө·пјҢе…¶д»–жҠ•иһҚиө„йЎ№зӣ®е…ұ12иө·пјҢеҢ…жӢ¬жүӢжңҜеҢ»з–—еҷЁжў°/и®ҫеӨҮзұ»гҖҒеҢ»зҫҺзұ»зӯүгҖӮ
2022е№ҙ7жңҲеҢ»з–—еҷЁжў°иЎҢдёҡжҠ•иһҚиө„еӣҫи°ұ

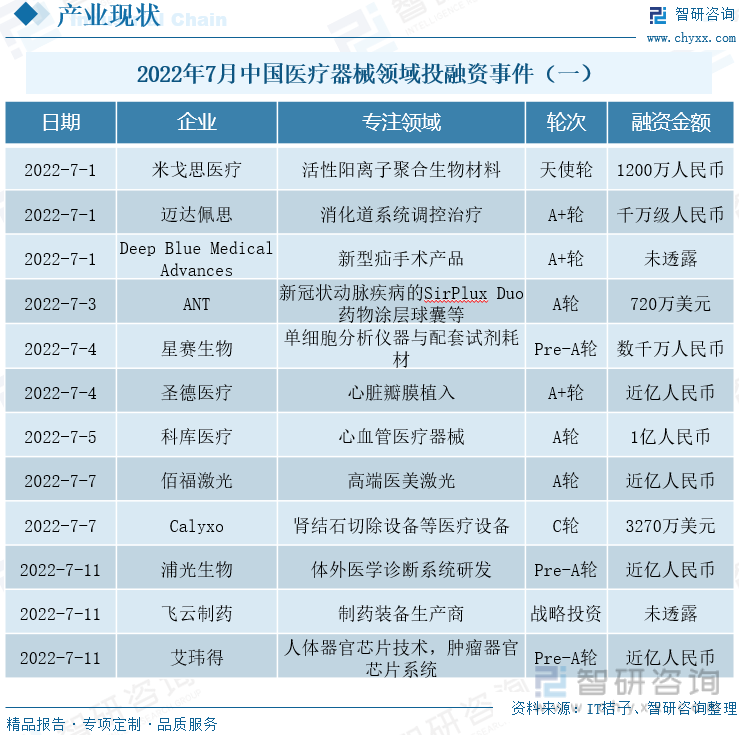
2022е№ҙ7жңҲдёӯеӣҪеҢ»з–—еҷЁжў°йўҶеҹҹжҠ•иһҚиө„дәӢ件пјҲдёҖпјү
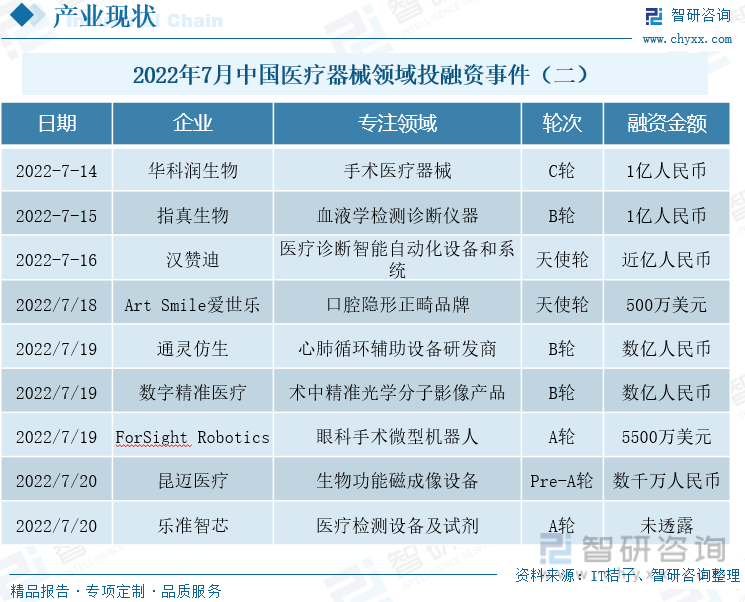
2022е№ҙ7жңҲдёӯеӣҪеҢ»з–—еҷЁжў°йўҶеҹҹжҠ•иһҚиө„дәӢ件пјҲдәҢпјү
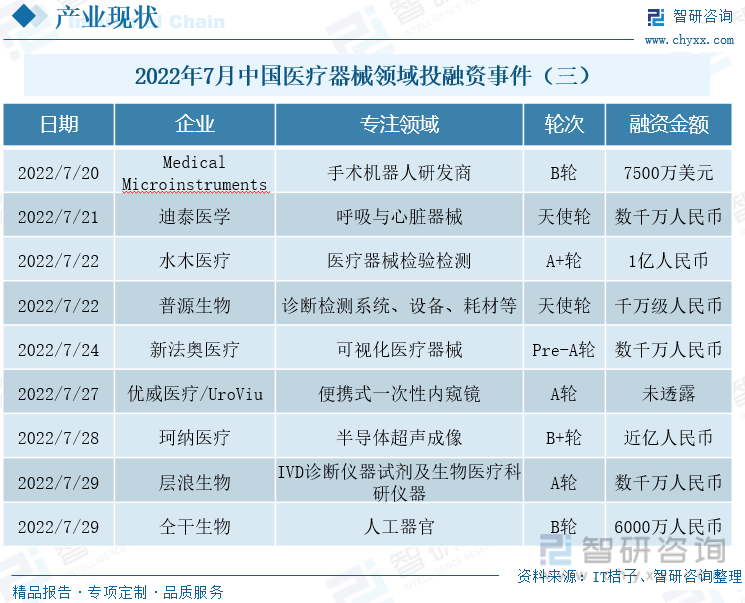
2022е№ҙ7жңҲдёӯеӣҪеҢ»з–—еҷЁжў°йўҶеҹҹжҠ•иһҚиө„дәӢ件пјҲдёүпјү
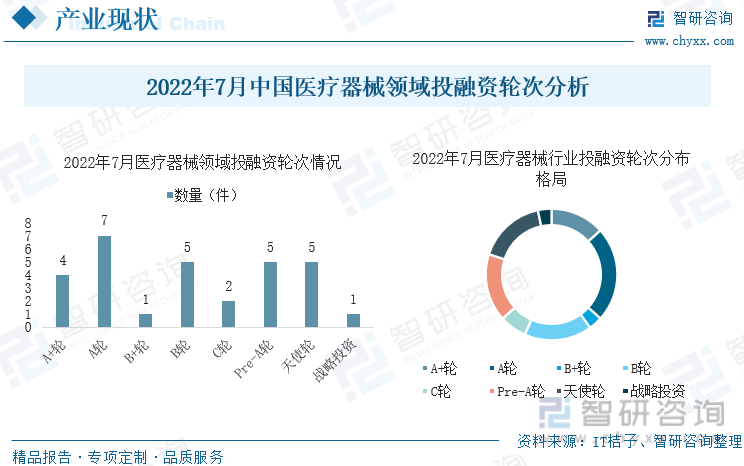
ж №жҚ®ITжЎ”еӯҗж•°жҚ®жҳҫзӨәпјҢ7жңҲеҢ»з–—еҷЁжў°иЎҢдёҡжҠ•иһҚиө„дәӢ件е…ұи®Ў30件гҖӮд»ҺжҠ•иһҚиө„иҪ®ж¬ЎзңӢпјҢAиҪ®иһҚиө„дәӢ件жҺ’еңЁйҰ–дҪҚпјҢе…ұжңү7иө·пјҢе…¶ж¬ЎBиҪ®гҖҒPre-AеӨ©дҪҝиҪ®гҖҒеӨ©дҪҝиҪ®пјҢзҡҶеҲҶеҲ«жңү5иө·гҖӮ
2022е№ҙ7жңҲдёӯеӣҪеҢ»з–—еҷЁжў°йўҶеҹҹжҠ•иһҚиө„иҪ®ж¬ЎеҲҶжһҗ
дёүгҖҒиЎҢдёҡдә§е“Ғе®Ўжү№еӨҮжЎҲеҠЁжҖҒ
2022е№ҙ7жңҲпјҢеӣҪ家иҚҜе“Ғзӣ‘зқЈз®ЎзҗҶеұҖе…ұжү№еҮҶжіЁеҶҢеҢ»з–—еҷЁжў°дә§е“Ғ197дёӘгҖӮе…¶дёӯпјҢеўғеҶ…第дёүзұ»еҢ»з–—еҷЁжў°дә§е“Ғ152дёӘпјҢиҝӣеҸЈз¬¬дёүзұ»еҢ»з–—еҷЁжў°дә§е“Ғ20дёӘпјҢиҝӣеҸЈз¬¬дәҢзұ»еҢ»з–—еҷЁжў°дә§е“Ғ22дёӘпјҢжёҜжҫіеҸ°еҢ»з–—еҷЁжў°дә§е“Ғ3дёӘгҖӮ
2022е№ҙ7жңҲжү№еҮҶжіЁеҶҢеҢ»з–—еҷЁжў°дә§е“Ғжғ…еҶөеҲҶжһҗ
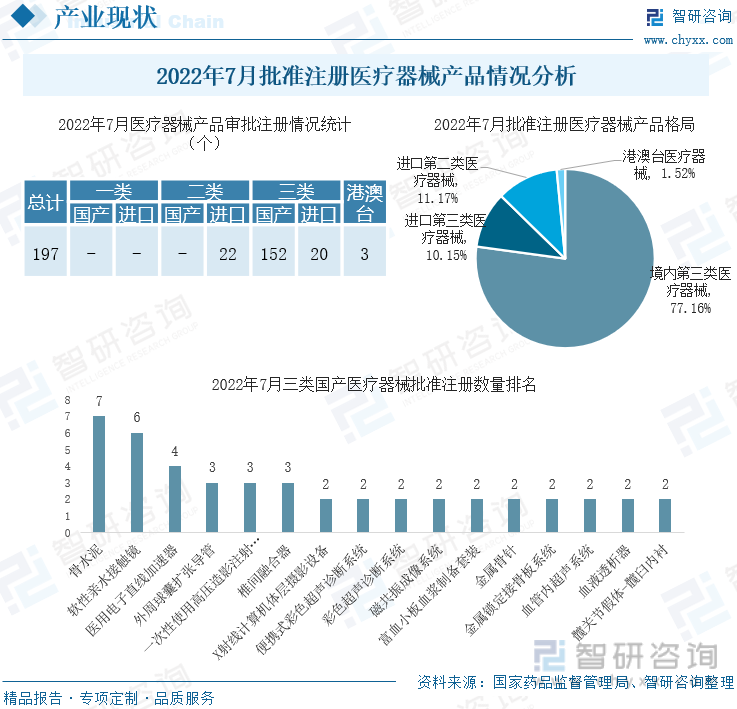
2022е№ҙ7жңҲпјҢйӘЁж°ҙжіҘжү№еҮҶжіЁеҶҢж•°йҮҸ7дёӘпјҢжҺ’еңЁйҰ–дҪҚпјӣе…¶ж¬ЎжҳҜиҪҜжҖ§дәІж°ҙжҺҘи§Ұй•ң6дёӘпјҢжҺ’еңЁз¬¬дәҢдҪҚпјӣеҢ»з”Ёз”өеӯҗзӣҙзәҝеҠ йҖҹеҷЁжү№еҮҶжіЁеҶҢж•°йҮҸ4дёӘгҖӮйӘЁж°ҙжіҘиҺ·жү№дјҒдёҡж•°йҮҸд»…2家пјҢеҲҶеҲ«жҳҜжұҹиӢҸд№җй“ з”ҹзү©жҠҖжңҜжңүйҷҗе…¬еҸёиҺ·жү№жіЁеҶҢ6дёӘпјҢеұұдёңжҳҺеҫ·з”ҹзү©еҢ»еӯҰе·ҘзЁӢжңүйҷҗе…¬еҸёиҺ·жү№жіЁеҶҢ1дёӘгҖӮ
жҲӘиҮі2022е№ҙ7жңҲ31ж—ҘпјҢдёӯеӣҪеҗ„зңҒеўғеҶ…еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢиҜҒ9.39дёҮдёӘпјҢеӨҮжЎҲиҜҒ12.51дёҮдёӘпјӣеҢ»з–—еҷЁжў°з”ҹдә§и®ёеҸҜиҜҒ1.62дёҮдёӘпјҢеӨҮжЎҲиҜҒ2.03дёҮдёӘпјӣеҢ»з–—еҷЁжў°з»ҸиҗҘи®ёеҸҜиҜҒ35.04дёҮдёӘпјҢеӨҮжЎҲиҜҒ108.42дёҮдёӘгҖӮ
2022е№ҙ7жңҲеҢ»з–—еҷЁжў°и®ёеҸҜеӨҮжЎҲжғ…еҶө
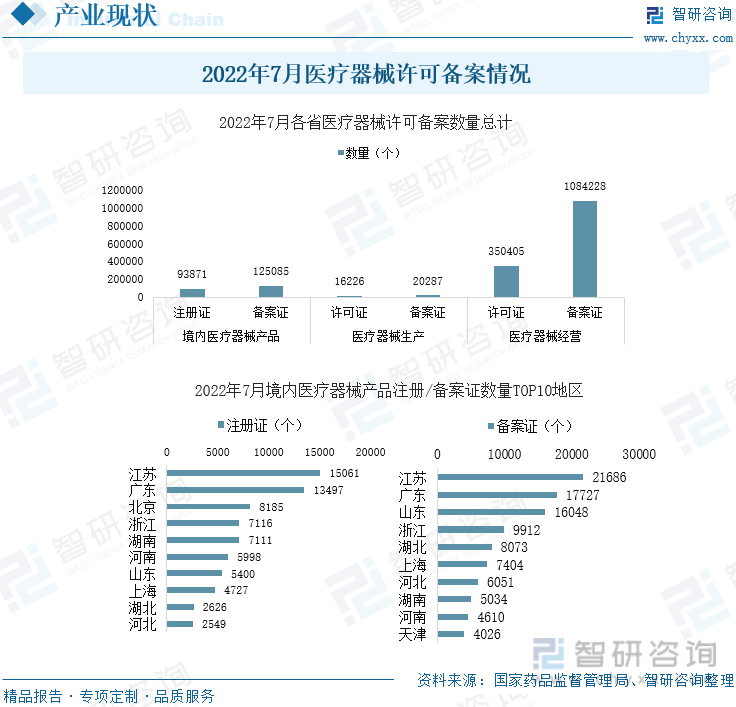
7жңҲпјҢдёӯеӣҪеўғеҶ…еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢж•°йҮҸжҺ’еҗҚеүҚдёүзҡ„зңҒд»ҪдёәжұҹиӢҸгҖҒе№ҝдёңгҖҒеҢ—дә¬пјҢеҲҶеҲ«дёә15061дёӘгҖҒ13497дёӘгҖҒ8185дёӘгҖӮеўғеҶ…еҢ»з–—еҷЁжў°дә§е“ҒеӨҮжЎҲж•°йҮҸжҺ’еҗҚеүҚдёүзҡ„зңҒд»ҪдёәжұҹиӢҸгҖҒе№ҝдёңеҸҠеұұдёңпјҢеҲҶеҲ«дёә21686дёӘгҖҒ17727дёӘгҖҒ16048дёӘгҖӮ7жңҲпјҢе…ЁеӣҪеўғеҶ…еҢ»з–—еҷЁжў°дә§е“ҒжіЁеҶҢгҖҒеӨҮжЎҲжңҖеӨҡзҡ„ең°еҢәжҳҜжұҹиӢҸпјҢе…¶ж¬ЎжҳҜе№ҝдёңгҖӮ
зӣёе…іжҠҘе‘Ҡпјҡжҷәз ”е’ЁиҜўеҸ‘еёғзҡ„гҖҠ2022-2028е№ҙдёӯеӣҪеҢ»з–—еҷЁжў°иЎҢдёҡе…ЁжҷҜи°ғз ”еҸҠз«һдәүж јеұҖйў„жөӢжҠҘе‘ҠгҖӢ
еӣӣгҖҒдә§дёҡйӣҶзҫӨеҠЁжҖҒ
еҠЁжҖҒ1пјҡеӣҪдҝЎеҢ»иҚҜиҗҪжҲ·иӢҸе·һз”ҹзү©еҢ»иҚҜдә§дёҡеӣӯ
иҝ‘ж—ҘпјҢиӢҸе·һеӣҪдҝЎеҢ»иҚҜз”ҹзү©з§‘жҠҖжңүйҷҗе…¬еҸёжӯЈејҸиҗҪжҲ·иӢҸе·һз”ҹзү©еҢ»иҚҜдә§дёҡеӣӯпјҲBioBAYпјүпјҢжӯӨдёҫж Үеҝ—зқҖеӣҪдҝЎеҢ»иҚҜиҝҲеҗ‘ж–°зҡ„еҸ‘еұ•йҮҢзЁӢзў‘пјҢж·ұеәҰиҒҡз„Ұз»Ҷиғһеҹәеӣ жІ»з–—гҖҒж ёй…ёиҚҜзү©йўҶеҹҹпјҢжҸҗдҫӣе…Ёе‘ЁжңҹжңҚеҠЎпјҢжү“йҖ з”ҹе‘Ҫ科еӯҰз ”з©¶е№іеҸ°е’ҢеҚҺдёңең°еҢәеҲӣж–°й«ҳең°пјҢе…ЁеҠӣиҝҲеҗ‘вҖң第дёҖж–№йҳөвҖқгҖӮ
еҠЁжҖҒ2пјҡеӨ©зӣ®еҢ»иҚҜжёҜеӯөеҢ–еӣӯ
7жңҲ4ж—ҘпјҢ2021з”ҹе‘ҪеҒҘеә·еӨ©зӣ®иҚҹжҙ»еҠЁеңЁжқӯе·һдёҙе®үеҢәдёҫеҠһпјҢеӨ©зӣ®еҢ»иҚҜжёҜеӯөеҢ–еӣӯжӯЈејҸејҖеӣӯпјҢ17дёӘжҖ»жҠ•иө„24дәҝе…ғзҡ„йЎ№зӣ®зӯҫзәҰжӯЈејҸиҗҪжҲ·еӨ©зӣ®еҢ»иҚҜжёҜеӯөеҢ–еӣӯгҖӮдҪңдёәеҹҺиҘҝ科еҲӣеӨ§иө°е»Ҡзҡ„йҮҚиҰҒдёҖзҺҜпјҢиҝ‘е№ҙжқҘпјҢдёҙе®үеҢәиҒҡз„Ұз”ҹе‘ҪеҒҘеә·йўҶеҹҹпјҢеҹ№иӮІеүҚжІҝжҠҖжңҜжҲҗжһңпјҢжҸҗеҚҮзЎ¬ж ёз§‘жҠҖеҺҹеҲӣеҠӣпјҢжү“йҖ з”ҹе‘ҪеҒҘеә·з§‘еҲӣй«ҳең°пјҢе°Ҷе…ЁеҠӣжҺЁеҠЁдә§дёҡеҸ‘еұ•пјҢз«Ӣи¶із”ҹе‘ҪеҒҘеә·дә§дёҡеҹәзЎҖпјҢе»әз«ӢеҒҘе…Ёз ”еҸ‘гҖҒеӯөеҢ–гҖҒеҠ йҖҹгҖҒдә§дёҡеӣӯеҢәе…Ёй“ҫжқЎдҪ“зі»пјҢиҒҡз„Ұж–°еһӢеҢ–еӯҰиҚҜзү©гҖҒз”ҹзү©жҠҖжңҜиҚҜзү©гҖҒзҺ°д»ЈдёӯиҚҜгҖҒй«ҳз«ҜеҢ»з–—еҷЁжў°зӯүйҮҚзӮ№йўҶеҹҹејҖеұ•зІҫеҮҶжӢӣе•ҶпјҢзқҖеҠӣжү“йҖ з”ҹе‘ҪеҒҘеә·дә§дёҡз”ҹжҖҒеңҲгҖӮ
еҠЁжҖҒ3пјҡж№–еҚ—иҺ·жү№и®ҫз«ӢвҖңжө·еіЎдёӨеІёдә§дёҡеҗҲдҪңеҢәвҖқ
7жңҲ5ж—Ҙж¶ҲжҒҜпјҢеӣҪеҠЎйҷўеҸ°еҠһгҖҒеӣҪ家еҸ‘改委гҖҒе·ҘдҝЎйғЁгҖҒе•ҶеҠЎйғЁдәҺиҝ‘ж—ҘжӯЈејҸжү№еӨҚеҗҢж„ҸеңЁж№–еҚ—зңҒи®ҫз«ӢвҖңвҖңжө·еіЎдёӨеІёдә§дёҡеҗҲдҪңеҢәвҖқгҖӮж№–еҚ—жҲҗдёәе…ЁеӣҪ第дә”дёӘиҺ·жү№и®ҫз«ӢиҜҘдә§дёҡеҗҲдҪңеҢәзҡ„зңҒд»ҪгҖӮж№–еҚ—жө·еіЎдёӨеІёдә§дёҡеҗҲдҪңеҢәеҢ…жӢ¬еІійҳідә§дёҡеӣӯгҖҒж№ҳжҪӯдә§дёҡеӣӯгҖҒйғҙе·һдә§дёҡеӣӯдёүеӨ§дә§дёҡеӣӯгҖӮе…¶дёӯпјҢеІійҳідә§дёҡеӣӯеҠҹиғҪе®ҡдҪҚдёәж№ҳеҸ°з”өеӯҗдҝЎжҒҜдә§дёҡеӣӯе’ҢеӣҪ家зә§еҸ°ж№ҫеҶңж°‘еҲӣдёҡеӣӯпјҢдё»еҜјдә§дёҡдёәз”өеӯҗдҝЎжҒҜдә§дёҡгҖҒзҺ°д»ЈеҶңдёҡпјӣж№ҳжҪӯдә§дёҡеӣӯеҠҹиғҪе®ҡдҪҚдёәд»ҘжҷәиғҪеҲ¶йҖ йӣҶиҒҡйӣҶзҫӨеҸ‘еұ•еҢәе’ҢзҺ°д»ЈеҢ»з–—еҷЁжў°йӣҶзҫӨеҸ‘еұ•еҢәдёәдё»зҡ„еҸ°иө„дјҒдёҡйӣҶдёӯеҢәпјӣйғҙе·һдә§дёҡеӣӯеҠҹиғҪе®ҡдҪҚдёәе…ЁеӣҪжүҝжҺҘеҸ°е•ҶеҸ°дјҒзҡ„зӨәиҢғеҢәгҖҒе…ҲеҜјеҢәпјҢдё»еҜјдә§дёҡдёәжңүиүІйҮ‘еұһж–°жқҗж–ҷдә§дёҡгҖҒз”өеӯҗдҝЎжҒҜдә§дёҡгҖӮ
еҠЁжҖҒ4пјҡй•ҝжІҷеҒҘеә·з”ҹжҖҒ科жҠҖдә§дёҡеӣӯејҖе·Ҙе»әи®ҫ
7жңҲ5ж—ҘпјҢй•ҝжІҷпјҲеӣҪйҷ…пјүеҒҘеә·з”ҹжҖҒ科жҠҖдә§дёҡеӣӯжҡЁдёӯеә·дҝЎиҫҫе…ЁзҗғеҢ»з–—科жҠҖеұ•зӨәдәӨжҳ“дёӯеҝғй•ҝжІҷйҰҶйЎ№зӣ®еңЁжөҸйҳіз»ҸејҖеҢәпјҲй«ҳж–°еҢәпјүжӯЈејҸејҖе·Ҙе»әи®ҫгҖӮжӯӨж¬ЎејҖе·Ҙзҡ„й•ҝжІҷпјҲеӣҪйҷ…пјүеҒҘеә·з”ҹжҖҒ科жҠҖдә§дёҡеӣӯжҡЁдёӯеә·дҝЎиҫҫе…ЁзҗғеҢ»з–—科жҠҖеұ•зӨәдәӨжҳ“дёӯеҝғй•ҝжІҷйҰҶйЎ№зӣ®жҖ»жҠ•иө„60дәҝе…ғпјҢз”ұеӨ®дјҒеӨ§жңүеӣҪиҒ”жҺ§иӮЎжңүйҷҗе…¬еҸёе…Ёиө„еӯҗе…¬еҸёдёӯй“ҒжҳҠеӨ©жҺ§иӮЎжңүйҷҗе…¬еҸёгҖҒжі°еҮӯпјҲеҢ—дә¬пјүе®һдёҡжңүйҷҗиҙЈд»»е…¬еҸёжҠ•иө„е»әи®ҫгҖӮе…¶дёӯпјҢй•ҝжІҷпјҲеӣҪйҷ…пјүеҒҘеә·з”ҹжҖҒ科жҠҖдә§дёҡеӣӯйЎ№зӣ®е»әи®ҫз”Ёең°1605дә©пјҢеҲҶдёӨжңҹе»әи®ҫпјҢе»әжҲҗеҗҺе°Ҷе®һзҺ°дә§еҖј300дәҝе…ғпјҢзЁҺ收10дәҝе…ғд»ҘдёҠгҖӮ
еҠЁжҖҒ5пјҡйқ’еІӣеёӮе·Ёеі°е…үеӯҰеҢ»з–—еҷЁжў°дә§дёҡеӣӯз«Је·ҘйӘҢ收
7жңҲ6ж—ҘпјҢеҺҶж—¶20дёӘжңҲпјҢдҪңдёәзңҒеёӮдјҳйҖүйЎ№зӣ®еҸҠеҙӮеұұеҢәйҮҚзӮ№еӣәжҠ•йЎ№зӣ®зҡ„йқ’еІӣеёӮе·Ёеі°е…үеӯҰеҢ»з–—еҷЁжў°дә§дёҡеӣӯзӣ®еүҚе·Іиҝӣе…Ҙз«Је·ҘйӘҢ收йҳ¶ж®өгҖӮе·Ёеі°е…үеӯҰеҢ»з–—еҷЁжў°дә§дёҡеӣӯжҳҜйқ’еІӣ巨峰科жҠҖеҲӣдёҡжҠ•иө„жңүйҷҗе…¬еҸёдёҺйқ’еІӣжқ°з”ҹз”өж°”жңүйҷҗе…¬еҸёзҡ„еҗҲдҪңејҖеҸ‘йЎ№зӣ®гҖӮиҜҘйЎ№зӣ®жҖ»е»әзӯ‘йқўз§Ҝ8.67дёҮе№іж–№зұіпјҢз»“еҗҲеҙӮеұұеҢәйҮҚзӮ№жү“йҖ зҡ„еҢ»иҚҜеҒҘеә·дё»еҜјдә§дёҡпјҢеӣӯеҢәе®ҡдҪҚдёәз”ҹзү©еҢ»иҚҜеҸҠеҢ»з–—еҷЁжў°дә§дёҡйўҶеҹҹпјҢд»ҘеҸҠдә§дёҡдёҠдёӢжёёзӣёе…іжңҚеҠЎжңәжһ„гҖӮ巨峰科еҲӣдёҺдёӯдҝЎеҹәйҮ‘гҖҒеёӮзә§еҲӣдёҡжҠ•иө„еј•еҜјеҹәйҮ‘з®ЎзҗҶдёӯеҝғгҖҒжң—еЁҒжҺ§иӮЎйӣҶеӣўзӯүеҚ•дҪҚеҗҲдҪңжҲҗз«ӢдәҶ10дәҝе…ғзҡ„дёӯдҝЎеҢ»з–—дә§дёҡеҹәйҮ‘пјҢдёәеҢ»з–—зұ»йЎ№зӣ®иҗҪжҲ·жҸҗдҫӣиө„жң¬ж”Ҝж’‘пјҢеҪўжҲҗдәҶ вҖңеӣӯеҢәејҖеҸ‘+иө„жң¬ж”ҜжҢҒ+йЎ№зӣ®е…Ҙй©»вҖқзҡ„е»әи®ҫжӢӣе•ҶжЁЎејҸпјҢеҠ йҖҹдёҺе‘Ёиҫ№еҢ»з–—зұ»дёҠдёӢжёёдјҒдёҡеҪўжҲҗдә§дёҡйӣҶиҒҡгҖӮ
д»ҘдёҠж•°жҚ®еҸҠдҝЎжҒҜеҸҜеҸӮиҖғжҷәз ”е’ЁиҜўпјҲwww.chyxx.comпјүеҸ‘еёғзҡ„гҖҠ2022-2028е№ҙдёӯеӣҪеҢ»з–—еҷЁжў°иЎҢдёҡе…ЁжҷҜи°ғз ”еҸҠз«һдәүж јеұҖйў„жөӢжҠҘе‘ҠгҖӢгҖӮжҷәз ”е’ЁиҜўжҳҜдёӯеӣҪйўҶе…Ҳдә§дёҡе’ЁиҜўжңәжһ„пјҢжҸҗдҫӣж·ұеәҰдә§дёҡз ”з©¶жҠҘе‘ҠгҖҒе•Ҷдёҡи®ЎеҲ’д№ҰгҖҒеҸҜиЎҢжҖ§з ”究жҠҘе‘ҠеҸҠе®ҡеҲ¶жңҚеҠЎзӯүдёҖз«ҷејҸдә§дёҡе’ЁиҜўжңҚеҠЎгҖӮжӮЁеҸҜд»Ҙе…іжіЁгҖҗжҷәз ”е’ЁиҜўгҖ‘е…¬дј—еҸ·пјҢжҜҸеӨ©еҸҠж—¶жҺҢжҸЎжӣҙеӨҡиЎҢдёҡеҠЁжҖҒгҖӮ
 жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ
жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ

2024-2030е№ҙдёӯеӣҪеҢ»з–—еҷЁжў°иЎҢдёҡе…ЁжҷҜи°ғз ”еҸҠз«һдәүж јеұҖйў„жөӢжҠҘе‘Ҡ
гҖҠ2024-2030е№ҙдёӯеӣҪеҢ»з–—еҷЁжў°иЎҢдёҡе…ЁжҷҜи°ғз ”еҸҠз«һдәүж јеұҖйў„жөӢжҠҘе‘ҠгҖӢе…ұеҚҒеӣӣз« пјҢеҢ…еҗ«2024-2030е№ҙеҢ»з–—еҷЁжў°иЎҢдёҡеүҚжҷҜеҸҠи¶ӢеҠҝпјҢеҢ»з–—еҷЁжў°иЎҢдёҡжҠ•иө„жңәйҒҮдёҺйЈҺйҷ©з ”究пјҢеҢ»з–—еҷЁжў°иЎҢдёҡз ”з©¶з»“и®әеҸҠе»әи®®зӯүеҶ…е®№гҖӮ
ж–Үз« иҪ¬иҪҪгҖҒеј•з”ЁиҜҙжҳҺпјҡ
жҷәз ”е’ЁиҜўжҺЁеҙҮдҝЎжҒҜиө„жәҗе…ұдә«пјҢж¬ўиҝҺеҗ„еӨ§еӘ’дҪ“е’ҢиЎҢз ”жңәжһ„иҪ¬иҪҪеј•з”ЁгҖӮдҪҶиҜ·йҒөе®ҲеҰӮдёӢ规еҲҷпјҡ
1.еҸҜе…Ёж–ҮиҪ¬иҪҪпјҢдҪҶдёҚеҫ—жҒ¶ж„Ҹй•ңеғҸгҖӮиҪ¬иҪҪйңҖжіЁжҳҺжқҘжәҗпјҲжҷәз ”е’ЁиҜўпјүгҖӮ
2.иҪ¬иҪҪж–Үз« еҶ…е®№ж—¶дёҚеҫ—иҝӣиЎҢеҲ еҮҸжҲ–дҝ®ж”№гҖӮеӣҫиЎЁе’Ңж•°жҚ®еҸҜд»Ҙеј•з”ЁпјҢдҪҶдёҚиғҪеҺ»йҷӨж°ҙеҚ°е’Ңж•°жҚ®жқҘжәҗгҖӮ
еҰӮжңүиҝқеҸҚд»ҘдёҠ规еҲҷпјҢжҲ‘们е°Ҷдҝқз•ҷиҝҪ究法еҫӢиҙЈд»»зҡ„жқғеҠӣгҖӮ
зүҲжқғжҸҗзӨәпјҡ
жҷәз ”е’ЁиҜўеҖЎеҜје°ҠйҮҚдёҺдҝқжҠӨзҹҘиҜҶдә§жқғпјҢеҜ№жңүжҳҺзЎ®жқҘжәҗзҡ„еҶ…е®№жіЁжҳҺеҮәеӨ„гҖӮеҰӮеҸ‘зҺ°жң¬з«ҷж–Үз« еӯҳеңЁзүҲжқғгҖҒзЁҝй…¬жҲ–е…¶е®ғй—®йўҳпјҢзғҰиҜ·иҒ”зі»жҲ‘们пјҢжҲ‘们е°ҶеҸҠж—¶дёҺжӮЁжІҹйҖҡеӨ„зҗҶгҖӮиҒ”зі»ж–№ејҸпјҡgaojian@chyxx.comгҖҒ010-60343812гҖӮ






