дёҖгҖҒдёҙеәҠиҜ•йӘҢз»„й•ҝеҚ•дҪҚеҸҠеҸӮеҠ еҚ•дҪҚ
1гҖҒдёҙеәҠиҜ•йӘҢз»„й•ҝеҚ•дҪҚ
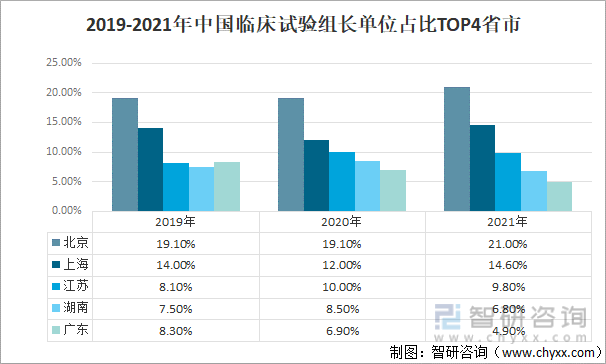
2019-2021е№ҙдёӯеӣҪзҷ»и®°зҡ„иҚҜзү©дёҙеәҠиҜ•йӘҢдёӯпјҢеҢ—дә¬еёӮдёҙеәҠиҜ•йӘҢжңәжһ„дҪңдёәз»„й•ҝеҚ•дҪҚеҸӮеҠ дёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°жңҖеӨҡпјҢеҚ жҜ”дҫқж¬Ўдёә19.1%гҖҒ19.1%гҖҒ21.0%пјӣе…¶ж¬ЎжҳҜдёҠжө·пјҢдҪңдёәз»„й•ҝеҚ•дҪҚеҸӮеҠ дёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°еҚ жҜ”еҲҶеҲ«дёә14.0%гҖҒгҖҒ12.0%гҖҒ14.6%пјӣ第дёүжҳҜжұҹиӢҸпјҢдҪңдёәз»„й•ҝеҚ•дҪҚеҸӮеҠ дёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°еҚ жҜ”еҲҶеҲ«дёә8.1%гҖҒ10.0%гҖҒ9.8%пјӣ第еӣӣгҖҒ第дә”еҲҶеҲ«дёәж№–еҚ—гҖҒе№ҝдёңпјҢ2021е№ҙдҪңдёәз»„й•ҝеҚ•дҪҚеҸӮеҠ дёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°еҚ жҜ”еҲҶеҲ«дёә6.8%гҖҒ4.9%гҖӮ
2019-2021е№ҙдёӯеӣҪдёҙеәҠиҜ•йӘҢз»„й•ҝеҚ•дҪҚеҚ жҜ”TOP4зңҒеёӮ
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
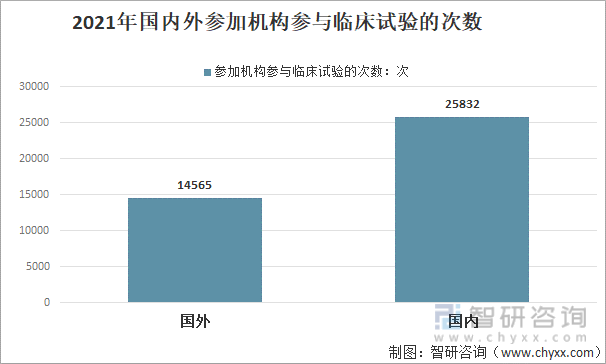
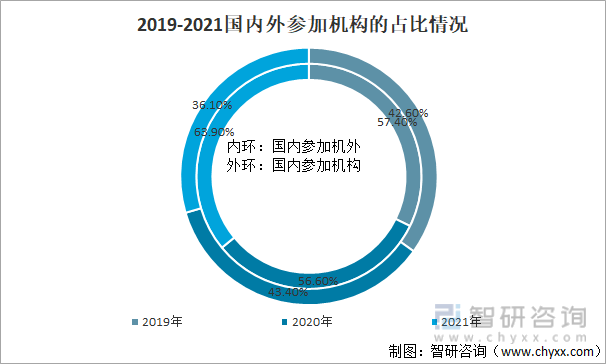
2021е№ҙпјҢдёӯеӣҪе…ЁйғЁиҚҜзү©дёҙеәҠиҜ•йӘҢе…ұж¶үеҸҠеӣҪеҶ…еӨ–дёҙеәҠиҜ•йӘҢеҚ•дҪҚ40397ж¬ЎпјҲеҰӮ1дёӘдёҙеәҠиҜ•йӘҢеҚ•дҪҚеҗҢж—¶дҪңдёәеӨҡйЎ№дёҙеәҠиҜ•йӘҢзҡ„еҸӮеҠ еҚ•дҪҚпјҢеҲҷжҢүе…¶еҸӮеҠ дёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°еҲҶеҲ«з»ҹи®ЎдёҖж¬ЎпјүпјҢе…¶дёӯпјҡдёӯеӣҪеӣҪеҶ…пјҲеҢ…жӢ¬жёҜжҫіеҸ°пјүеҸӮеҠ еҚ•дҪҚе…ұи®Ў25832ж¬ЎпјҢеҚ 63.9%пјӣеӣҪеӨ–еҸӮеҠ жңәжһ„жңү14565ж¬ЎпјҢеҚ 36.1%гҖӮ
2021е№ҙеӣҪеҶ…еӨ–еҸӮеҠ жңәжһ„еҸӮдёҺдёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
2019-2021еӣҪеҶ…еӨ–еҸӮеҠ жңәжһ„зҡ„еҚ жҜ”жғ…еҶө
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
зӣёе…іжҠҘе‘Ҡпјҡжҷәз ”е’ЁиҜўеҸ‘еёғзҡ„гҖҠ2022-2028е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡз«һдәүж јеұҖеҲҶжһҗеҸҠеёӮеңәеүҚжҷҜи¶ӢеҠҝжҠҘе‘ҠгҖӢ
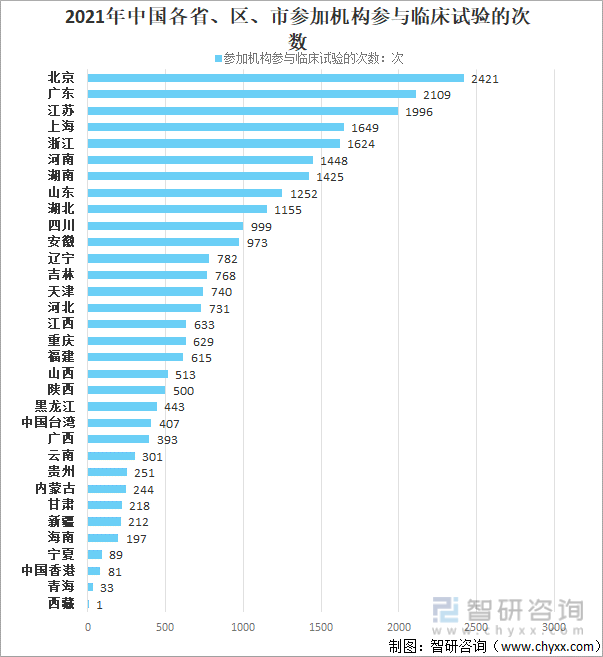
2021е№ҙеӣҪеҶ…пјҲеҢ…жӢ¬жёҜжҫіеҸ°пјүж–°иҚҜдёҙеәҠиҜ•йӘҢеҚ•дҪҚжҺ’еҗҚе…ЁеӣҪеүҚдёүзҡ„зңҒеёӮеҲҶеҲ«дёәеҢ—дә¬гҖҒе№ҝдёңгҖҒжұҹиӢҸпјҢеҸӮеҠ жңәжһ„еҸӮдёҺдёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°еҲҶеҲ«дёә2421ж¬ЎгҖҒ2109ж¬ЎгҖҒ1996ж¬ЎгҖӮдёҠжө·гҖҒжөҷжұҹгҖҒж№–еҚ—гҖҒжІіеҚ—гҖҒеұұдёңгҖҒж№–еҢ—еқҮи¶…иҝҮ1000ж¬ЎгҖӮ
2021е№ҙдёӯеӣҪеӣҪеҶ…еҗ„зңҒгҖҒеҢәгҖҒеёӮеҸӮеҠ жңәжһ„еҸӮдёҺдёҙеәҠиҜ•йӘҢзҡ„ж¬Ўж•°
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
дәҢгҖҒдёҙеәҠиҜ•йӘҢиҖ—ж—¶еҸҠеҸ—иҜ•иҖ…жӢӣеӢҹжғ…еҶө
1гҖҒеҗҜеҠЁдёҙеәҠиҜ•йӘҢиҖ—ж—¶еҲҶжһҗ
2021е№ҙеңЁе·Ізҷ»и®°зҡ„819йЎ№еӣҪеҶ…жңүж•ҲйҰ–дҫӢеҸ—иҜ•иҖ…зҹҘжғ…еҗҢж„Ҹд№ҰпјҲICFпјүж—Ҙжңҹдё”ж— зӣёе…ізҷ»и®°еҸ·дҝЎжҒҜпјҲеҚіжҺ’йҷӨ2021е№ҙд»ҘеүҚиҺ·жү№дҪҶеңЁ2021е№ҙж–°еўһиҜ•йӘҢзӯүе…¶д»–жғ…еҪўпјүпјҢж №жҚ®ICFж—Ҙжңҹе’ҢдёҙеәҠиҜ•йӘҢиҺ·жү№ж—Ҙжңҹи®Ўз®—дёҙеәҠиҜ•йӘҢеҗҜеҠЁиҖ—ж—¶пјҢж—¶й—ҙиҢғеӣҙдёә3еӨ©-91дёӘжңҲпјҢе№іеқҮеҖјдёә12.2дёӘжңҲгҖӮ
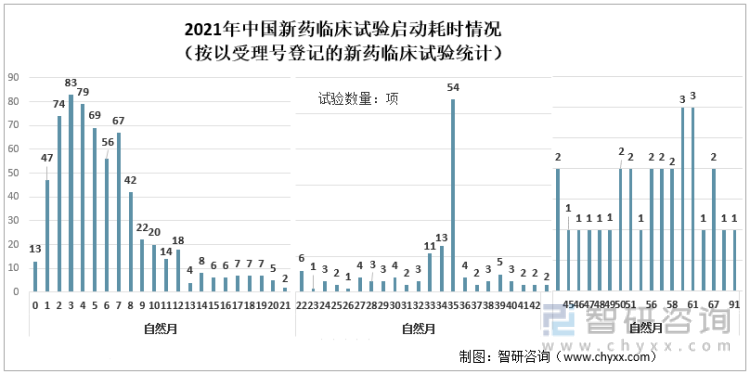
2021е№ҙдёӯеӣҪж–°иҚҜдёҙеәҠиҜ•йӘҢеҗҜеҠЁиҖ—ж—¶жғ…еҶөпјҲжҢүд»ҘеҸ—зҗҶеҸ·зҷ»и®°зҡ„ж–°иҚҜдёҙеәҠиҜ•йӘҢз»ҹи®Ўпјү
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
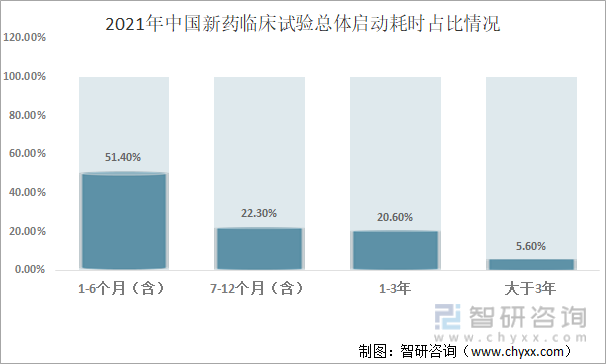
д»Һ2021е№ҙдёӯеӣҪж–°иҚҜдёҙеәҠиҜ•йӘҢжҖ»дҪ“еҗҜеҠЁиҖ—ж—¶еҚ жҜ”жқҘзңӢпјҢж–°иҚҜдёҙеәҠиҜ•йӘҢжҖ»дҪ“еҗҜеҠЁиҖ—ж—¶еңЁ1-6дёӘжңҲпјҲеҗ«пјүзҡ„еҚ 51.4%пјӣ7-12дёӘжңҲпјҲеҗ«пјүзҡ„еҚ 22.3%пјӣ1-3е№ҙзҡ„еҚ 20.6%пјӣеӨ§дәҺ3е№ҙзҡ„еҚ 5.6%пјҢеҸҜд»ҘзңӢеҮәдёҖеҚҠд»Ҙе№ҙзҡ„иҜ•йӘҢеңЁ6дёӘжңҲеҶ…еҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹгҖӮ
2021е№ҙдёӯеӣҪж–°иҚҜдёҙеәҠиҜ•йӘҢжҖ»дҪ“еҗҜеҠЁиҖ—ж—¶еҚ жҜ”жғ…еҶө
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
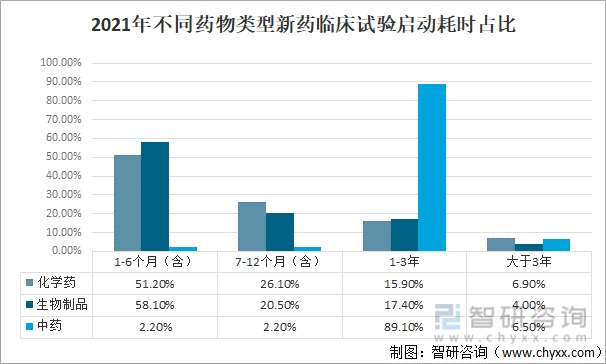
2021е№ҙпјҢдёӯеӣҪеҢ–еӯҰиҚҜеңЁ1-6дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә51.20%пјҢеңЁ7-12дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә26.10%пјҢеңЁ1-3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢжҳҺдёә15.90%пјҢеӨ§дәҺ3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә6.90%пјӣз”ҹзү©еҲ¶е“ҒеңЁ1-6дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә58.10%пјҢеңЁ7-12дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә20.50%пјҢеңЁ1-3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢжҳҺдёә17.40%пјҢеӨ§дәҺ3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә4.00%пјӣдёӯиҚҜеңЁ1-6дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә2.20%пјҢеңЁ7-12дёӘжңҲпјҲеҗ«пјүеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә2.20%пјҢеңЁ1-3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢжҳҺдёә89.10%пјҢеӨ§дәҺ3е№ҙеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹзҡ„жҜ”дҫӢдёә6.50%гҖӮ
2021е№ҙпјҢдёӯеӣҪдёҚеҗҢиҚҜзү©зұ»еһӢж–°иҚҜдёҙеәҠиҜ•йӘҢеҗҜеҠЁиҖ—ж—¶еҚ жҜ”
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
2гҖҒиҜ•йӘҢиҺ·жү№еҗҺеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹжғ…еҶө
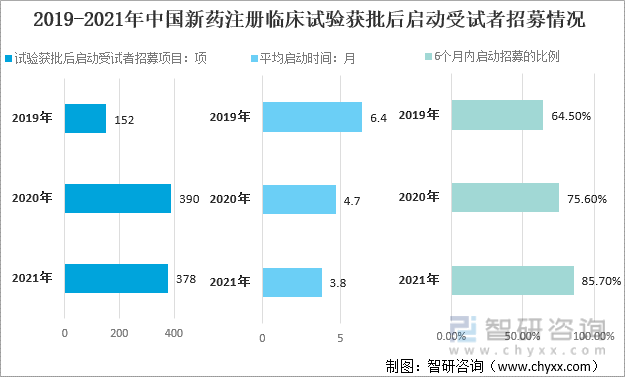
д»Һ2021е№ҙдёӯеӣҪж–°иҚҜжіЁеҶҢдёҙеәҠиҜ•йӘҢиҺ·жү№еҗҺеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹжғ…еҶөжқҘзңӢпјҢиҜ•йӘҢиҺ·жү№еҗҺеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹйЎ№зӣ®378йЎ№пјҢе№іеқҮеҗҜеҠЁж—¶й—ҙ3.8жңҲпјҢ6дёӘжңҲеҶ…еҗҜеҠЁжӢӣеӢҹзҡ„жҜ”дҫӢдёә85.7%гҖӮ
2019-2021е№ҙдёӯеӣҪж–°иҚҜжіЁеҶҢдёҙеәҠиҜ•йӘҢиҺ·жү№еҗҺеҗҜеҠЁеҸ—иҜ•иҖ…жӢӣеӢҹжғ…еҶө
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
дёүгҖҒдёҙеәҠиҜ•йӘҢе®ҢжҲҗжғ…еҶөеҲҶжһҗ
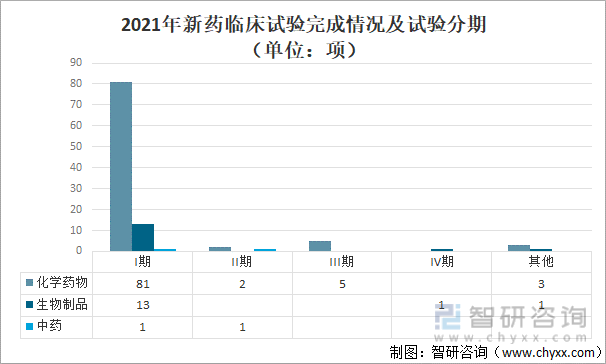
2021е№ҙд»ҘеҸ—зҗҶеҸ·зҷ»и®°зҡ„2033йЎ№ж–°иҚҜдёҙеәҠиҜ•йӘҢдёӯпјҢе·Іе®ҢжҲҗ108йЎ№пјҢе…¶дёӯпјҡеҢ–еӯҰиҚҜзү©жңү91йЎ№пјҢеҢ…жӢ¬Iжңҹ81йЎ№пјӣIIжңҹ 2йЎ№пјӣIIIжңҹ5йЎ№пјӣе…¶д»–3йЎ№гҖӮз”ҹзү©еҲ¶е“Ғжңү15йЎ№пјҢеҢ…жӢ¬Iжңҹ13йЎ№пјӣIVжңҹ 1йЎ№пјӣе…¶д»–1йЎ№гҖӮдёӯиҚҜжңү2йЎ№пјҢIжңҹгҖҒIIжңҹеҗ„1йЎ№гҖӮ
2021е№ҙж–°иҚҜдёҙеәҠиҜ•йӘҢе®ҢжҲҗжғ…еҶөеҸҠиҜ•йӘҢеҲҶжңҹпјҲеҚ•дҪҚпјҡйЎ№пјү
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
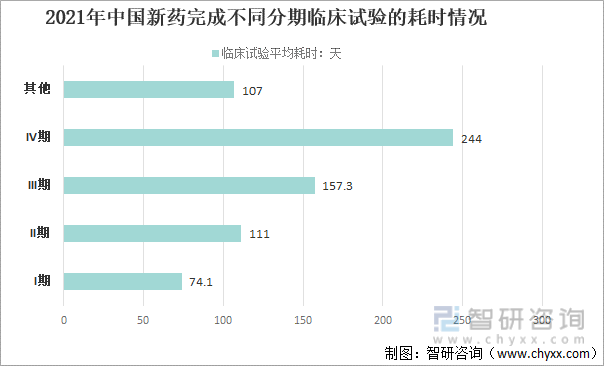
2021е№ҙпјҢдёӯеӣҪж–°иҚҜе®ҢжҲҗдёҚеҗҢеҲҶжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶жғ…еҶөжқҘзңӢпјҢIжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶74.1еӨ©пјӣIIжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶111еӨ©пјӣIIIжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶157.3еӨ©пјӣIVжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶244еӨ©пјӣе…¶д»–дёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶107еӨ©гҖӮ
2021е№ҙдёӯеӣҪж–°иҚҜе®ҢжҲҗдёҚеҗҢеҲҶжңҹдёҙеәҠиҜ•йӘҢзҡ„иҖ—ж—¶жғ…еҶө
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
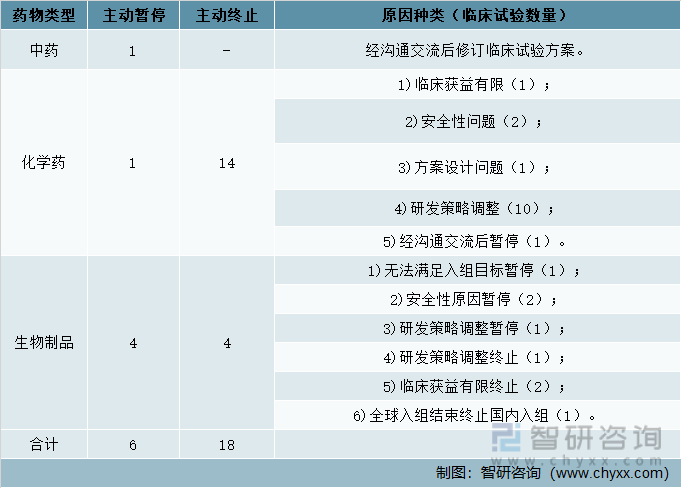
2021е№ҙдёӯеӣҪж–°иҚҜжҡӮеҒңйЎ№зӣ®6йЎ№пјҢе…¶дёӯпјҡдёӯиҚҜгҖҒеҢ–еӯҰиҚҜеҗ„1йЎ№пјҢз”ҹзү©еҲ¶е“Ғжңү4йЎ№пјҢдё»еҠЁз»ҲжӯўйЎ№зӣ®е…ұ18йЎ№пјҢе…¶дёӯпјҡеҢ–еӯҰиҚҜ14йЎ№пјҢз”ҹзү©еҲ¶е“Ғ4йЎ№гҖӮ
2021е№ҙдёӯеӣҪеҗ„зұ»еһӢж–°иҚҜжҡӮеҒңжҲ–з»ҲжӯўйЎ№зӣ®ж•°еҸҠеҺҹеӣ
иө„ж–ҷжқҘжәҗпјҡеӣҪ家иҚҜе®ЎдёӯеҝғгҖҒжҷәз ”е’ЁиҜўж•ҙзҗҶ
иҝ‘дёүе№ҙж•°жҚ®еҲҶжһҗпјҢеңЁеҪ“е№ҙе®ҢжҲҗдёҙеәҠиҜ•йӘҢдёӯпјҢдё»иҰҒд»ҘеҢ–еӯҰиҚҜв… жңҹдёҙеәҠиҜ•йӘҢдёәдё»пјҢ2019е№ҙ-2021е№ҙеҚ жҜ”еҲҶеҲ«дёә69.6%гҖҒ61.2%е’Ң75.0%пјӣжҢүиҜ•йӘҢеҲҶжңҹеҲҶжһҗе®ҢжҲҗж—¶й—ҙпјҢв… жңҹдёҙеәҠиҜ•йӘҢиҖ—ж—¶зӣёеҜ№иҫғе°‘пјҢиҢғеӣҙдёә74.1еӨ©-95.7еӨ©гҖӮ2021е№ҙжҡӮеҒңе’Ңз»ҲжӯўиҜ•йӘҢжҖ»йҮҸжҳҺжҳҫй«ҳдәҺ2019е№ҙе’Ң2020е№ҙпјҢжҡӮеҒңе’Ңз»ҲжӯўеҺҹеӣ дёӯеӣ з ”еҸ‘зӯ–з•Ҙи°ғж•ҙеӣ зҙ еҚ 50%пјҲ12vs.24пјү;жҢүиҜ•йӘҢеҲҶжңҹеҲҶжһҗпјҢ37.5%пјҲ9vs.24пјүзҡ„иҜ•йӘҢеңЁв… жңҹйҳ¶ж®өдё»еҠЁз»Ҳжӯў,еҚ жҜ”жңҖй«ҳпјӣжӯӨеӨ–пјҢжңү12.5%пјҲ3vs.24пјүиҜ•йӘҢеңЁв…ўжңҹйҳ¶ж®өдё»еҠЁз»Ҳжӯў,е…¶дёӯеҢ…еҗ«1йЎ№дёӯжңҹеҲҶжһҗз»“жһңжңӘиҺ·еҫ—йҳіжҖ§з»“жһңгҖӮ
д»ҘдёҠж•°жҚ®еҸҠдҝЎжҒҜеҸҜеҸӮиҖғжҷәз ”е’ЁиҜўпјҲwww.chyxx.comпјүеҸ‘еёғзҡ„гҖҠ2022-2028е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡз«һдәүж јеұҖеҲҶжһҗеҸҠеёӮеңәеүҚжҷҜи¶ӢеҠҝжҠҘе‘ҠгҖӢгҖӮжҷәз ”е’ЁиҜўжҳҜдёӯеӣҪйўҶе…Ҳдә§дёҡе’ЁиҜўжңәжһ„пјҢжҸҗдҫӣж·ұеәҰдә§дёҡз ”з©¶жҠҘе‘ҠгҖҒе•Ҷдёҡи®ЎеҲ’д№ҰгҖҒеҸҜиЎҢжҖ§з ”究жҠҘе‘ҠеҸҠе®ҡеҲ¶жңҚеҠЎзӯүдёҖз«ҷејҸдә§дёҡе’ЁиҜўжңҚеҠЎгҖӮжӮЁеҸҜд»Ҙе…іжіЁгҖҗжҷәз ”е’ЁиҜўгҖ‘е…¬дј—еҸ·пјҢжҜҸеӨ©еҸҠж—¶жҺҢжҸЎжӣҙеӨҡиЎҢдёҡеҠЁжҖҒгҖӮ
 жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ
жҷәз ”е’ЁиҜў - зІҫе“ҒжҠҘе‘Ҡ

2024-2030е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡиҝҗиҗҘзҺ°зҠ¶еҸҠеёӮеңә规模预жөӢжҠҘе‘Ҡ
гҖҠ2024-2030е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡиҝҗиҗҘзҺ°зҠ¶еҸҠеёӮеңә规模预жөӢжҠҘе‘ҠгҖӢе…ұеҚҒдёҖз« пјҢеҢ…еҗ«дёӯеӣҪеҲӣж–°иҚҜдә§дёҡеӣҪйҷ…з«һдәүеҠӣеҲҶжһҗпјҢ2024-2030е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡеҸ‘еұ•и¶ӢеҠҝеұ•жңӣеҲҶжһҗпјҢ2024-2030е№ҙдёӯеӣҪеҲӣж–°иҚҜиЎҢдёҡжҠ•иө„йЈҺйҷ©еҲҶжһҗеҸҠе»әи®®зӯүеҶ…е®№гҖӮ
ж–Үз« иҪ¬иҪҪгҖҒеј•з”ЁиҜҙжҳҺпјҡ
жҷәз ”е’ЁиҜўжҺЁеҙҮдҝЎжҒҜиө„жәҗе…ұдә«пјҢж¬ўиҝҺеҗ„еӨ§еӘ’дҪ“е’ҢиЎҢз ”жңәжһ„иҪ¬иҪҪеј•з”ЁгҖӮдҪҶиҜ·йҒөе®ҲеҰӮдёӢ规еҲҷпјҡ
1.еҸҜе…Ёж–ҮиҪ¬иҪҪпјҢдҪҶдёҚеҫ—жҒ¶ж„Ҹй•ңеғҸгҖӮиҪ¬иҪҪйңҖжіЁжҳҺжқҘжәҗпјҲжҷәз ”е’ЁиҜўпјүгҖӮ
2.иҪ¬иҪҪж–Үз« еҶ…е®№ж—¶дёҚеҫ—иҝӣиЎҢеҲ еҮҸжҲ–дҝ®ж”№гҖӮеӣҫиЎЁе’Ңж•°жҚ®еҸҜд»Ҙеј•з”ЁпјҢдҪҶдёҚиғҪеҺ»йҷӨж°ҙеҚ°е’Ңж•°жҚ®жқҘжәҗгҖӮ
еҰӮжңүиҝқеҸҚд»ҘдёҠ规еҲҷпјҢжҲ‘们е°Ҷдҝқз•ҷиҝҪ究法еҫӢиҙЈд»»зҡ„жқғеҠӣгҖӮ
зүҲжқғжҸҗзӨәпјҡ
жҷәз ”е’ЁиҜўеҖЎеҜје°ҠйҮҚдёҺдҝқжҠӨзҹҘиҜҶдә§жқғпјҢеҜ№жңүжҳҺзЎ®жқҘжәҗзҡ„еҶ…е®№жіЁжҳҺеҮәеӨ„гҖӮеҰӮеҸ‘зҺ°жң¬з«ҷж–Үз« еӯҳеңЁзүҲжқғгҖҒзЁҝй…¬жҲ–е…¶е®ғй—®йўҳпјҢзғҰиҜ·иҒ”зі»жҲ‘们пјҢжҲ‘们е°ҶеҸҠж—¶дёҺжӮЁжІҹйҖҡеӨ„зҗҶгҖӮиҒ”зі»ж–№ејҸпјҡgaojian@chyxx.comгҖҒ010-60343812гҖӮ






